amorf, kristal, eerste orde oorgang
glasoorgangstemperatuur, hittekapasitiet, latente hitte
tweede orde oorgang, termiese oorgang
Nota: Voor jy hierdie bladsy lees, moet jy seker maak dat jy die blaaie oor die glasoorgang en polimeer kristalliniteit gelees het.
Differensïele skandeer kalorimetrie is 'n tegniek wat ons gebruik om die optrede van polimere te bestudeer as hulle verhit word. Ons gebruik dit om die sogenaamde termiese oorgange van 'n polimeer te bestudeer. Wat is hierdie termiese oorgange? Dit is die veranderinge wat binne 'n polimeer plaasvind soos dit verhit word. Die smelt van 'n kristallyne polimeer is een voorbeeld. Die glasoorgang is ook 'n termiese oorgang.Hoe sou ons nou 'n polimeer bestudeer as ons dit verhit? Wel, ek skat 'n mens sou begin om dit te verhit. En dit is presies wat in Differensïele Skandeer Kalorimetrie (of DSC, die Engelse afkorting soos dit algemeen gebruik word) gebeur.
Ons verhit ons polimeer in 'n apparaat wat byna so sal lyk:
Dit is eintlik heel eenvoudig. Daar is twee panne. In die een pan, die monsterpan, plaas jy jou polimeer monster. Die ander is die verwysingspan. Dit los jy leeg. Elkeen van die panne sit jy bo op 'n verhittingselement / plaat. Jy gee dan 'n instruksie aan die rekenaar om die elemente aan te skakel. Dit gebeur, en begin hulle verhit teen 'n spesifieke tempo, gewoonlik so teen 10 oC per minuut. Die rekenaar verseker dat die verhittingstempo absoluut eenders bly gedurende die hele eksperiment. 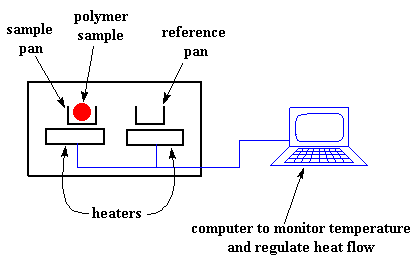
Maar nog belangriker, verseker die rekenaar dat die twee afsonderlikke panne, met hulle afsonderlike verhitters, ook teen presies dieselfde tempo verhit word.
Die vraag is nou: word hulle dan nie in elk geval teen dieselfde tempo warm nie? Die antwoord is nee. Die twee pannetjies verskil van mekaar (onthou die een het polimeer in en die ander nie). Aangesien die een ekstra materiaal in het, sal dit meer hitte nodig hê om die monsterpan by dieselfde temperatuur te kry / teen dieselfde tempo te verhit as die verwysingspan.
Die verhittingselement onder die monsterpannetjie moet dus harder werk as die een onder die verwysingspan. Dit moet meer hitte produseer. In 'n DSC eksperiment gaan ons meet presies hoeveel meer hitte word uitgesit deur die monsterpannetjie se element.
Ons doen dit op die volgende wyse: Ons trek 'n grafiek soos die temperatuur verhoog. Op die x-as plot ons die temperatuur. Op die y-as plot ons die verskil in hitte uitset tussen die twee verhittingselemente by 'n spesifieke temperatuur.
Hittekapasiteit
Ons kan heelwat leer uit so 'n grafiek. As ons begin om 'n polimeer warm te maak, sal die rekenaar die verskil in hitte uitset van die twee verhittingselemente plot teen die temperatuur. Ons sal dus eintlik die hitte geabsorbeer deur die polimeer plot teen temperatuur. Die grafiek sal heel moontlik so kan lyk:
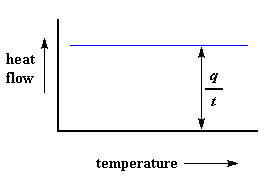
Die vloei van hitte by 'n spesifieke temperatuur word aangedui in eenhede van hitte, q verskaf per tydseenheid, t. Die verhittingstempo is die toename in temperatuur T per tydseenheid t.
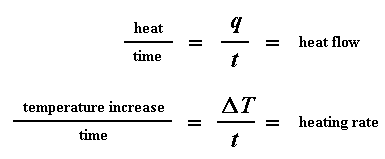
Kom ons neem die vloei van hitte q/t en verdeel dit deur die verhittingstempo T/t. Ons eindig met die hitte verskaf gedeel deur die toename in temperatuur.
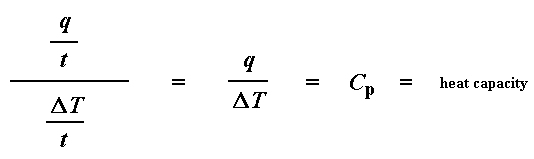
Onthou jy nog van die glasoorgang bladsy, dat as jy 'n spesifieke hoeveelheid hitte by iets voeg, die temperatuur met 'n spesifieke hoeveelheid sal opgaan, en die hoeveelheid hitte / energie benodig om 'n monster 'n sekere temperatuurverhoging te gee, die hittekapasiteit, of Cp genoem word. Ons kry die hittekapasiteit deur die hitte/energie verskaf deur die resulterende toename in temperatuur te verdeel. En dit is presies wat ons gedoen het in die vergelyking hier bo. Ons het die hittekapasiteit uit die DSC grafiek verkry!
Die Glasoorgangstemperatuur
Ons kan natuurlik baie meer as net 'n polimeer se hittekapasiteit verky met behulp van differensïele skandeer kalorimetrie. Kom ons kyk as ons die polimeer nog verder sou verhit. By 'n spesifieke temperatuur, sal die grafiek vinnig opwaarts skuif:
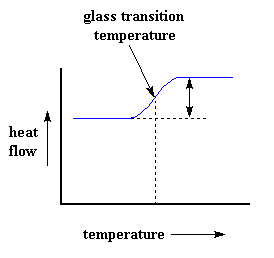
Dit beteken dus dat ons nou 'n groter vloei van hitte kry. Dit beteken ook dat ons 'n toename in die hittekapasiteit van die polimeer het. Dit gebeur omdat die polimeer nou deur sy glasoorgang gegaan het. En soos jy geleer het op die glasoorgang bladsy, het polimere 'n hoër hittekapasiteit bo hulle glasoorgangstemperatuur as onder dit. A.g.v. die verandering in hittekapasiteit wat tydens die glasoorgang plaasvind, kan ons DSC gebruik om 'n polimeer se glasoorgangstemperatuur te meet. Jy mag dalk opgelet het dat die verandering nie oombliklik plaasvind nie, maar eerder oor 'n temperatuurgebied. Dit maak dit dus moeilik om een diskrete Tg te kies, maar gewoonlik kies ons die middel van die helling as die Tg.
Kristallisasie
Maar wag, daar is heelwat meer as net dit. Bo die glasoorgang sal die polimere baie mobiel wees. Hulle sal kan draai en beweeg, en nie vir lank op een plek bly nie. Hulle kan rond beweeg aangesien hulle baie spasie het om in rond te beweeg. Maar, as hulle die regte temperatuur bereik, sal hulle genoeg energie besit om in baie geordende rangskikkings te beweeg. Ons noem dit natuurlik kristalle.Wanner polimere in hierdie kristallyne rangskikkings in gaan, gee hulle hitte af. As die hitte afgegee word, affekteer dit natuurlik die rekenaarbeheerde verhittingselement. Dit hoef nou nie so baie hitte in die sisteem in te sit om die temperatuur van die pannetjie te laat styg nie. Jy kan die verlaging in vloei van hitte sien as die groot afname in die grafiek van hittevloei teen temperatuur:
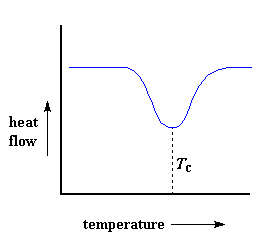
Hierdie verlaging vertel vir ons baie dinge. Die temperatuur by die laagste punt word gewoonlik geneem as die polimeer se kristallisasie temperatuur, of Tc. As ons die area van hierdie verlaging sou bereken, sou ons die latente hitte van polimeerkristallisasie verkry. Maar die heel belangrikste inligting wat hieruit sal kom, is die feit dat ons kan sien of die polimeer kristalliseer of nie. As jy 'n 100 % amorfe polimeer, soos ataktiese polistireen, sou analiseer, sal daar geen verlaging wees nie, aangesien hierdie materiaal nie kristalliseer nie.
Verder, omdat die polimeer hitte af gee wanneer dit kristalliseer, word kristallisasie 'n eksotermiese oorgang genoem.
Smelt
Hitte mag dalk die vorming van kristalle in 'n polimeer bevorder, maar te veel kan weer die vernietiging daarvan veroorsaak. As ons die polimeer verby sy Tc sou verhit, sal ons nog 'n verdere termiese oorgang bereik. As ons die polimeer se smelt temperatuur, of Tm, bereik, sal die polimeer kristalle uitmekaar uit begin val, d.w.s. hulle begin smelt. Die kettings sal nou uit hulle geordende rangskikkings kom, en begin om vry rond te beweeg. En, as jy gewonder het, ons kan dit ook op 'n DSC grafiek waarneem.Onthou jy nog dat die polimeer hitte uit gegee het toe dit gekristalliseer het? Wel, as die Tm bereik word, word die proses omgekeer. Daar is 'n latente smelthitte sowel as 'n latente hitte van kristallisasie. Wanneer die polimeerkristalle begin smelt, moet hulle hitte absorbeer om dit te laat gebeur. Onthou dat smelting 'n eerste order oorgang is. Dit beteken dus dat wanneer die smelt temperatuur bereik word, die polimeer se temperatuur nie sal toeneem voordat al die kristalle nie gesmelt het nie. Dit beteken dus dat die verhittingselement baie hard moet werk en baie energie moet insit om beide die kristalle te smelt en die temperatuur nog teen dieselfde tempo as die verwysingspan te laat toeneem. Hierdie ekstra vloei van hitte word gesien as 'n groot piek op die DSC grafiek:
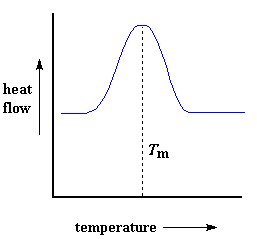
Ons kan die latente smelthitte bepaal deur die area van hierdie piek te verkry. Ons neem gewoonlik die temperatuur op die maksimum van die piek as die polimeer se smelt temperatuur, Tm. As ons dalk energie moet voeg by die polimeer om dit te laat smelt, sal ons dit 'n endotermiese oorgang noem.
'n Oorsig
Kom ons kyk nou na die hele proses: ons het 'n verandering gesien toe die polimeer verby sy glasoorgangstemperatuur verhit is. Daarna was daar 'n groot afname toe die polimeer sy kristallisasietemperatuur bereik het. En heel laastens het ons 'n groot piek gesien toe die polimeer sy smelt temperatuur bereik het. As ons dit nou alles sal saamvoeg, sal die hele grafiek dalk so kan lyk:

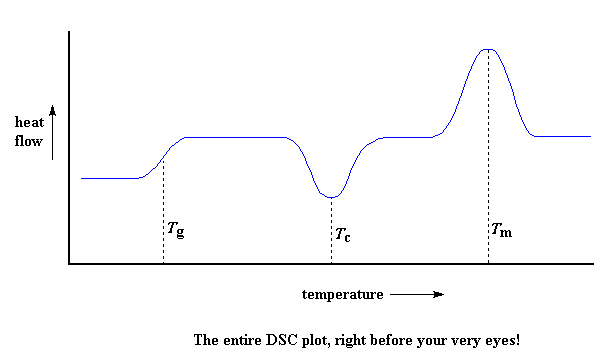
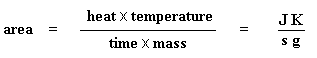
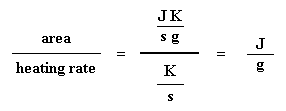
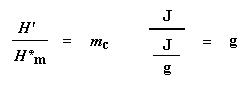
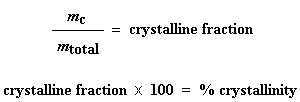
 Terug na die Vlak Vyf Kaart
Terug na die Vlak Vyf Kaart