

Sleutelwoorde
elektroliete,
ioon,
lukrake konformasie ("random coil").
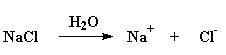
Poliëlektroliete is polimere wat presies dieselfde ding doen. Hulle breek op sodra hulle in water kom. 'n Voorbeeld? Wat van poliakrielsuur. As jy hierdie polimeer in water sit, sal die waterstofatome van die suurgroepe afsplit en saam met die water molekule H3O+ ione vorm:
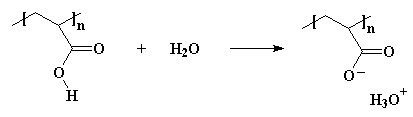
Maar wanneer die polimeerketting bedek is met negatiewe ladings (wat mekaar sal afstoot), kan die polimeer nie meer op homself draai nie. Die ketting strek dan uit, en lyk dan so:
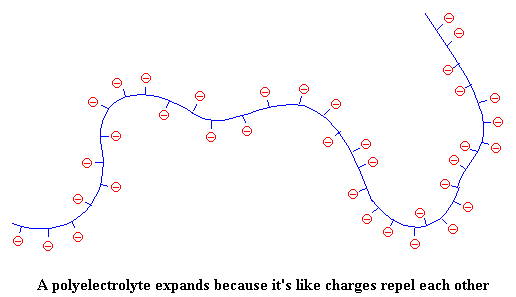
Dit maak nou die oplossing (onthou ons praat van poliëlektroliete in oplossing) meer viskoos. Dink so daaroor. As die poliëlektroliet ketting nou reguit uit strek, sal dit meer ruimte beslaan, en sal dus meer effektief wees om die vloei van oplosmiddelmolekules rondom dit te vertraag. Die eindresultaat is dus dat die oplossing dik en stroperig raak.
Maar daar is 'n manier wat jy kan verhoed dat dit gebeur. As jy 'n oplossing van 'n poliëlektroliet in water neem, en jy gooi 'n klomp sout by, gaan daar iets baie interessant gebeur. Die NaCl sal afsonderlike Na+ en Cl- ione vorm. In die geval van 'n negatief gelaaide poliëlektroliet soos poliakrielsuur, sal die positief gelaaide Na+ ione die negatiewe ladings op die polimeer kanseleer. As dit gebeur, sal die polimeer ketting dadelik weer 'n lukrake konformasie inneem.
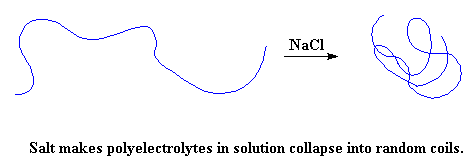
As jy my nie glo nie, probeer dit gerus self. Vat 'n lekker groot bol haargel en sit dit in 'n bak. Vat nou die soutpot, en gooi 'n KLOMP sout op die gel. Wel, as jy dit doen sal jy sien dat die gel sal verdwyn en 'n heel normale vloeistof sal oorbly. Dit is 'n aanduiding van hoe dramaties die verandering in viskositeit is as die polimeerkettings terugkeer na 'n lukrake konformasie.
 Terug na die Vlak Drie Kaart
Terug na die Vlak Drie Kaart Terug na die
Macrogalleria Indeks
Terug na die
Macrogalleria Indeks