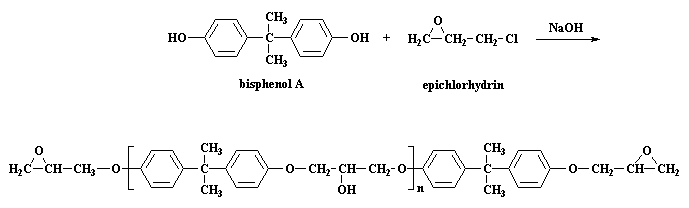
Daar is twee stappe in die sintese van epoksiharse. Eerstens moet jy 'n diëpoksied maak, en dan moet jy kruisbind met 'n diamien. Ons gaan dus afsonderlik oor elkeen van hierdie stappe praat. Jy kan enige van die twee eerste lees:
Hierdie is 'n tipe stapsgewyse groei polimerisasie reaksie. Ons maak 'n prepolimeer deur van bisfenol A en epichlorohidrien gebruik te maak. Die reaksie is dus, soos voorheen gesien op die epoksibladsye:

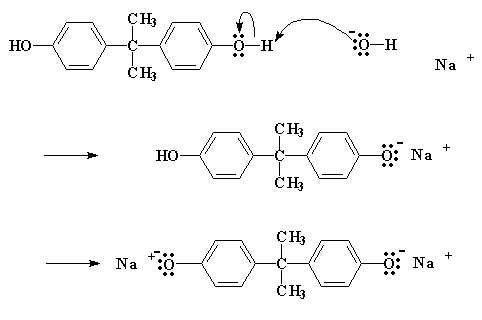
So, hoe werk hierdie reaksie? Die heel eerste ding wat gebeur is die bisfenol A en NaOH met mekaar reageer, om dan die bisfenol A as natriumsout te lewer.
Kliek hier om 'n film te sien van hierdie stap van die reaksie.
Die sout bevat 'n suurstof met drie elektronpare wat dit nie deel met enige ander atome nie. Hierdie suurstof is heel vrygewig, en will graag sy elektrone met ander atome deel. Dit vind dus 'n koolstofatoom op 'n nabygeleë epichlorohidrien, wat elektrone nodig het. Die koolstof is reg langs die chlooratoom, wat 'n baie sterk elektronegatiewe atoom is, en dus spandeer die elektrone meeste tyd in die omgewing van die chloor.
So doneer die suurstof dan 'n elektronpaar aan die koolstof. Die koolstofatoom kan natuurlik slegs vier elektronpare hê, en gee dus die elektrone af wat dit met die chloor gedeel het. Dit laat dus die chloor vry uit die molekuul.
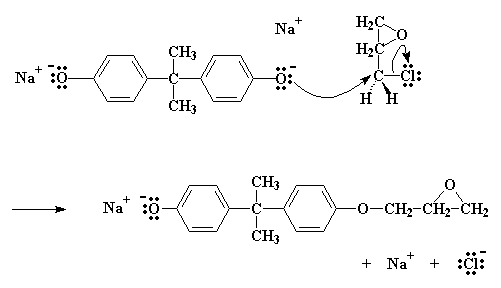
Kliek hier om 'n film te sien van hierdie stap in die reaksie.
Ons eindig dus met 'n molekule soortgelyk aan bisfenol A, slegs met 'n ekstra epoksigroep daaraan gekopppel. En ook NaCl.
Wel, 'n verskeidenheid dinge kan nou volgende gebeur. Onthou jy dalk nog hoe ons gesê het op die epoksibladsy hoe die prepolimere in verskillende molekulêre gewigte voorkom. Soms is die graad van polimerisasie so hoog soos 25. Maar partymaal kan dit so klein wees soos:
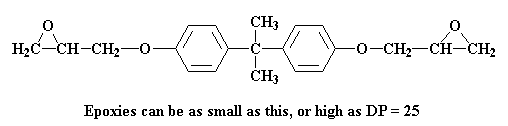
Hoe groot of klein die prepolimeer sal wees hang af van die verhouding van epichlorohidrien tot bisfenol A in die reaksiemengsel. Kom ons stel daardie verhouding vas op twee molekules epichlorohidrien vir elke molekuul bisfenol A. Kom ons kyk nou wat gebeur met die molekule wat ons nou net gemaak het by hierdie verhouding:
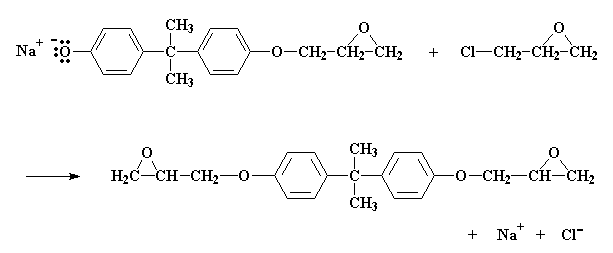
Wat sal gebeur is dat ons ook 'n epoksigroep aan die ander kant sal kry. Die reaksie stop dan, aangesien daar geen meer bisfenol A soutgroepe oor is om te reageer nie.
Wat sal gebeur as daar minder as twee molekules epichlorohidrien is vir elke bisfenol A molekule? Nie al die bisfenol A sout groepe sal kan reageer met epichlorohidrien nie. Kom ons sê die verhouding is drie molekules epichlorohidrien vir elke twee molekules bisfenol A. As al die epichlorohidrien molekules gereageer het, bevat die reaksiemengsel 'n 50:50 mengsel van hierdie twee molekules:
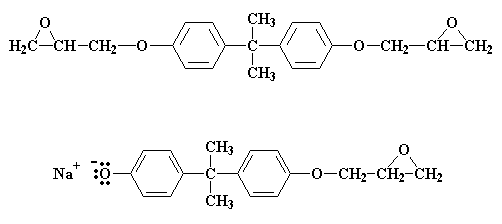
Hierdie twee molekules kan met mekaar reageer om die volgende te lewer:
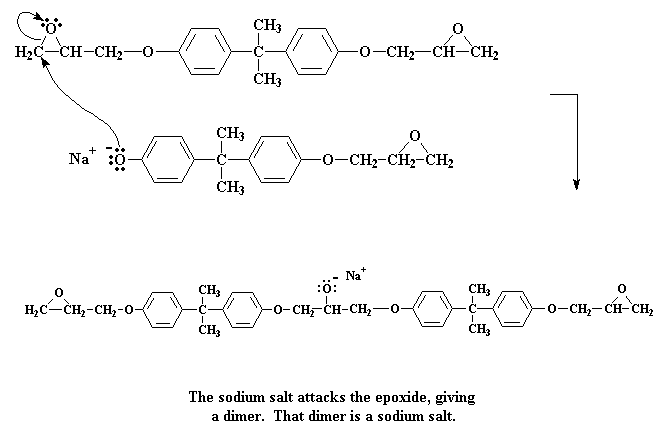
Kliek hier om 'n film te sien van hierdie stap van die reaksie.
Ons sit dus nou met 'n dimeer, wat ook 'n natriumsout is. Onthou van die negatiewe lading op die suurstofatoom. As 'n watermolekuul nou verby sou kom (onthou daar is 'n klomp watermolekules gegenereer toe die natriumsout van bisfenol A gemaak is), sal 'n elektronpaar van die suurstof een van die water se waterstowwe aanval, en dit "steel" by die water.
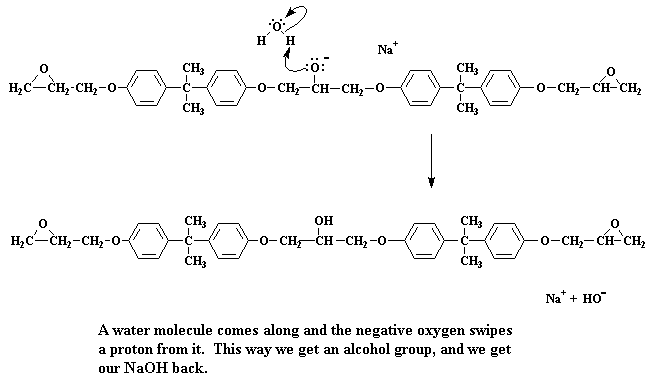
Kliek hier om 'n film te sien van hierdie stap van die reaksie.
Die suurstof vorm nou 'n alkoholgroep, en ons kry ons NaOH terug. Onthou jy nog die NaOH?
Hoe meer epichlorohidrien daar is relatief tot die hoeveelheid bisfenol A sout, hoe groter sal die oligomeer wees wat jy sal kry. Kan jy dink hoekom? Watter verhouding sou jy gebruik om trimere te kry?
As jy nou 'n film wil sien van die hele proses, kliek hier.
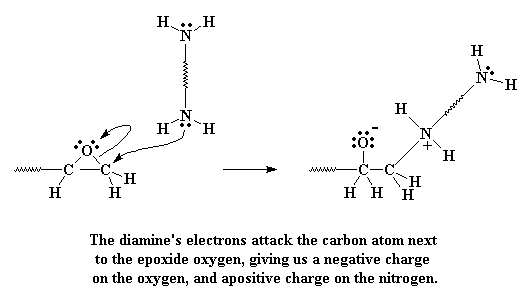
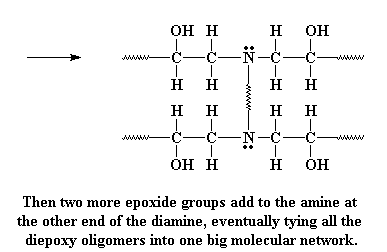
As jy eers 'n diëpoksi prepolimeer gemaak het, moet jy nog net die hele spul aan mekaar las. Ons doen dit deur 'n diamien by te voeg. Die diamien doen iets baie interessant wanneer dit naby die epoksigroepe van die prepolimeer kom. Die alleen elektronpare op die amiengroepe, op soek na 'n plek vir aanval, sien dat die epoksisuurstof al die elektrone weggeneem het van die koolstofatoom langs dit. Daar is dus 'n moontlik om die elektrone maklik oor te kan gee aan hierdie koolstofatome op die punte van die molekuul.
Kliek hier om 'n film te sien van hierdie stap in die reaksie.
As dit gebeur, gee die koolstof die elektrone op wat dit gedeel het met die suurstof. Die binding tussen die koolstof en suurstof word verbreek, en 'n nuwe binding vorm tussen die koolstof en die amienstikstof. Ons sit dus met 'n negatiewe lading op die koolstof, en 'n positiewe lading op die stikstof.
Alles nog onder beheer?
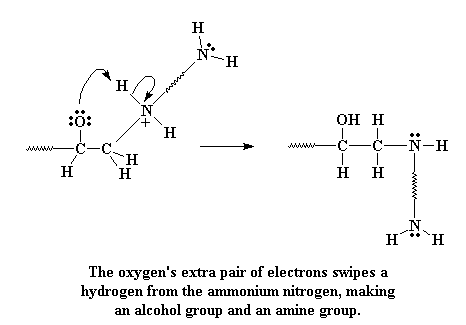
Kyk mooi na die suurstof. Suurstof hou van elektrone, en het drie elektronpare wat dit nie met ander atome deel nie. Van die nie-bindende elektrone kyk nou rond vir iets om mee te bind, en vind dan ook 'n waterstofatoom gebind aan die positiewe stikstof. Die elektrone val dan die waterstof aan.
Kliek hier om 'n film te sien van hierdie stap in die reaksie.
Wanner die suurstof aanval, vorm dit 'n binding met die waterstof, en die waterstof verlaat die stikstof, en los sy elektrone agter. Dit neutraliseer die positiewe lading op die stikstof. Die suurstof is natuurlik ook nou neutraal, na die toevoeging van 'n proton, en vorm nou 'n alkoholgroep.
As jy 'n film van die hele proses wil sien, kliek hier.
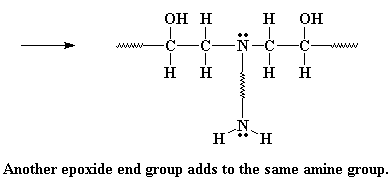
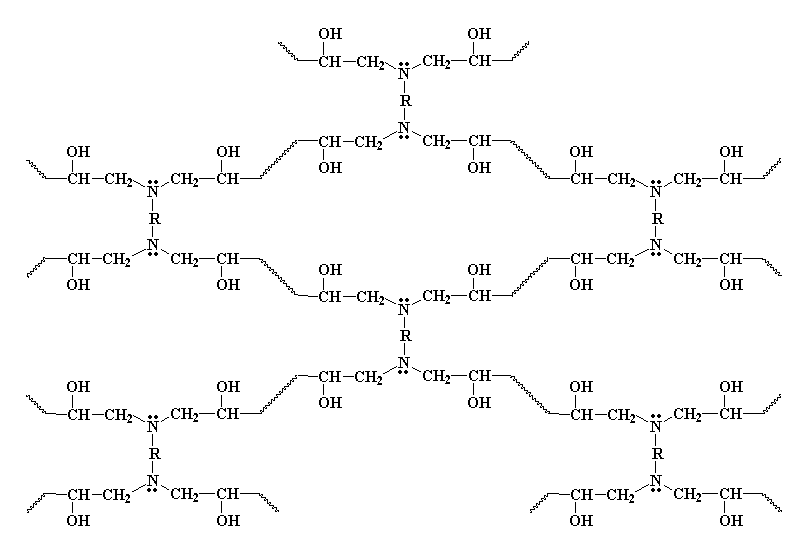
Die amiengroep het steeds 'n waterstof oor, en kan reageer met 'n volgende epoksigroep, op presies dieselfde wyse. Net so veel waterstowwe daar op die amien is, soveel epoksigroepe sal daar mee gereageer word. Hoekom? En dit is waarmee ons op die einde sit:
Set van die Diëpoksied met 'n diamien
 Terug na die Epoksihars Bladsy
Terug na die Epoksihars Bladsy Terug na die Vlak Vier Kaart
Terug na die Vlak Vier Kaart Terug na die
Macrogalleria Indeks
Terug na die
Macrogalleria Indeks