

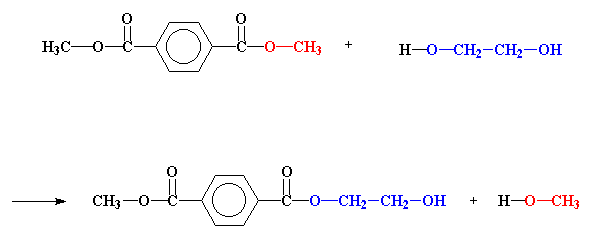
Sodra hierdie reagense bymekaar kom, begin dinge gebeur. Aangesien die dimetieltereftalaat 'n ester is, en die etileenglikol 'n alkohol is, sal met mekaar reageer. So 'n reaksie word 'n transesterifikasie reaksie genoem.
In hierdie reaksie word daar heelwat sygroepe uitgeruil. Kyk na een van die metoksigroepe op die dimetieltereftalaat (in rooi), en die hidroksiëtoksigroep (in blou) op die etileenglikol. Hierdie twee groepe gaan plekke ruil. Die hidroksiëtoksiegroep gaan eindig op die ester, daar waar die metoksigroep was. Die metoksigroep gaan verbind word aan 'n waterstof, en sit waar die hidroksiëtoksigroep was.
Dit is wat gebeur in die eerste stap in die sintese van 'n poliëster. Kom ons kyk nou na presies hoe dit gebeur.
Dit is belangrik om eerste na die dimetielterftelaat (die ester) te kyk, en meer spesifiek die karbonielkoolstof. Dit is verbind d.m.v. 'n dubbelbinding aan 'n suurstof. Die suurstof is meer elektronegatief as die koolstof, en sal dus die elektrone weg trek van die koolstofatoom af. Dit laat dan die koolstof met 'n parsiële positiewe lading, wat dit beskikbaar stel vir aanval (en die donering van elektrone).
Die vraag is nou net waar hierdie elektrone vandaan sal kom?
As daar 'n alkohol, soos etileenglikol, in die omgewing is, sal die ongedeelde elektronpare van die alkohol suurstofatome heel handig te pas kom. Dit is dan juis hierdie elektrone wat die koolstof sal aanval:
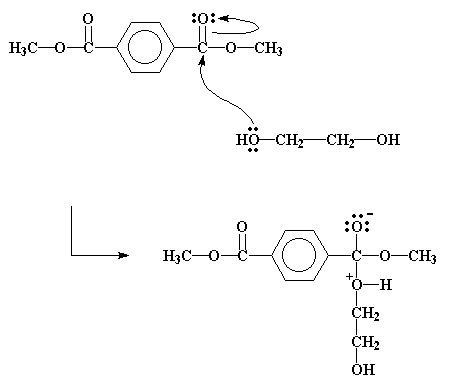
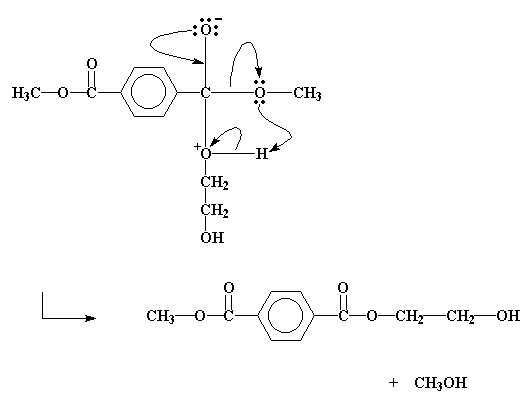
Die aanval verskuif dus nou 'n paar elektrone van die koolstof-suurstof dubbelbinding uit na die karbonielsuurstof, en gee dit dan 'n negatiewe lading. Die alkoholsuurstof sal egter nou 'n positiewe lading dra. Hierdie intermediaat sal 'n paar elektronverskuiwings ondergaan, soos deur die pyle gewys word. Die eindresultaat is dat die hidroksiëtielgroep vandie etileenglikol eindig op die estermolekuul, en die metielgroep van die ester word afgesplit om 'n molekule metanol te vorm.
En so gebeur dit dus dat die metielgroep en die hidroksiëtielgroep plekke omruil.
Metanol is 'n byproduk. Ons wil dit nie in die reaksiemengsel hê nie, en ons verwyder dit deur die reaksie by hoë genoeg temperatuur te laat verloop, en die metanol te laat verdamp. Behalwe vir die feit dat dit die metanol verwyder, help dit ook om die transesterifikasie reaksie se omsetting te verhoog. Onthou jy nog LeChatlier se beginsel?
Dieselfde reaksie sal ook aan die ander kant van die tereftalaat gebeur, en sodoende vir ons bis-2-hidroksiëtieltereftalaat lewer.
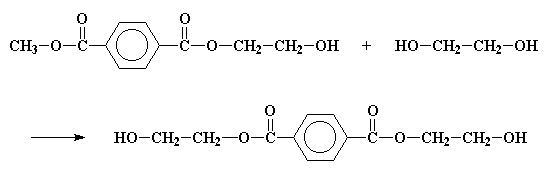
As jy bis-2-hidroksiëtieltereftalaat in 3d wil sien, kliek hier.
Nadat bis-2-hidroksiëtieltereftalaat gevorm is, moet dit nog verder reageer. Maar hierdie reaksies is maklik om te volg, aangesien hulle almal transesterifikasie reaksies is, soortgelyk aan die een wat ons nou net bekyk het. Kyk mooi. Die molekule is 'n alkohol en 'n ester. Dit kan dus ook transesterifiseer met homself, soos die figuur hier onder wys.
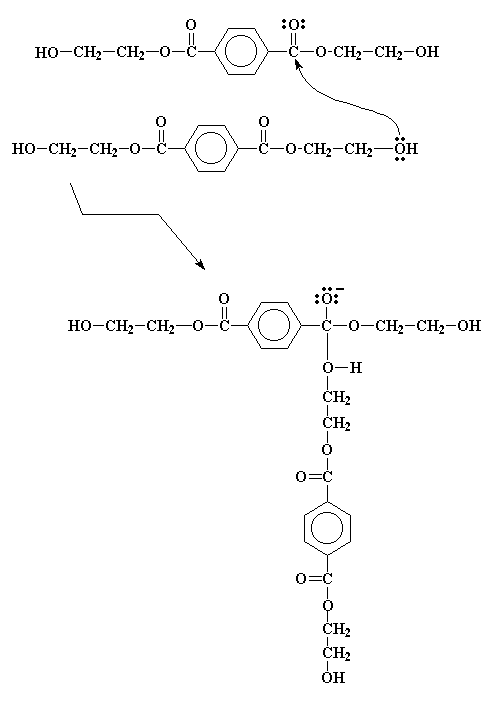
Dit vorm 'n intermediaat, soortelyk aan die een waarna ons voorheen gekyk het, en ondergaan soortgelyke elektronverskuiwings om die produk te verkry soos ons hier onder sien.
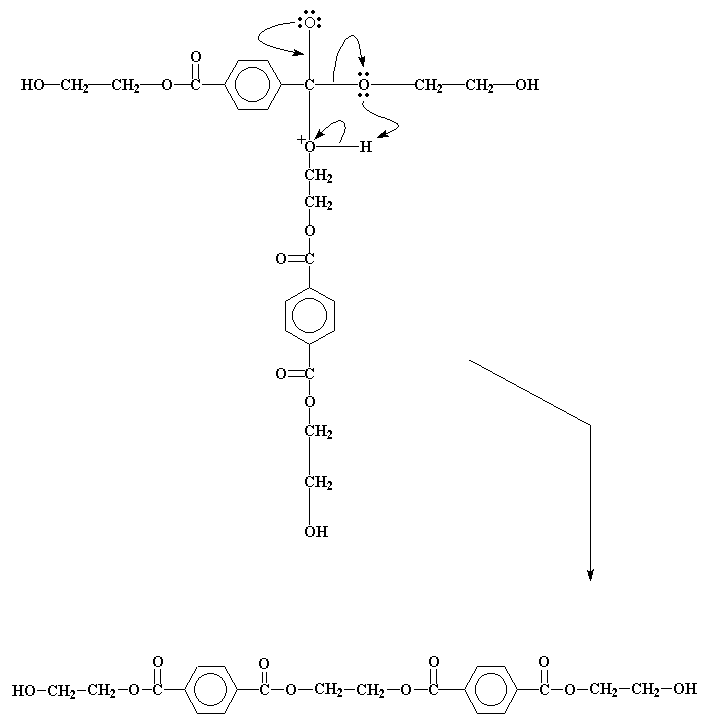
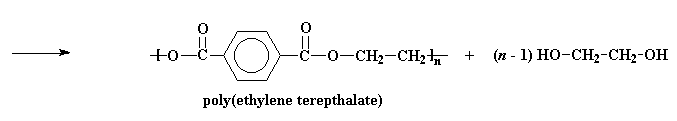
Hierdie produk kan weer reageer, net soos die bis-2-hidroksiëtieltereftelaat. As dit gebeur, word die gevormde molekule groter en groter, tot ons hoë molekulêre gewig PET kry!
 Terug na die Poliëster Bladsy
Terug na die Poliëster Bladsy Terug na die Vlak Vier Kaart
Terug na die Vlak Vier Kaart Terug na die
Macrogalleria Indeks
Terug na die
Macrogalleria Indeks