

Il y a deux étapes dans la fabrication des résines époxy. D'abord il faut fabriquer le diépoxy, et ensuite il faut le lier avec une diamine. Donc nous allons maintenant parler de ces deux étapes séparément. Vous pouvez commencer par celle que vous voulez
Fabrication du Diépoxy
Réaction du Diépoxy avec la Diamine
Cette étape est une sorte de
polymérisation par étape successives. Nous faisons le prépolymère avec du bisphénol A et de l'épichlorhydrine. Vous pouvez regarder ces molécules en 3-D en cliquant ici. Cette réaction est celle que vous avez vue sur la page époxy: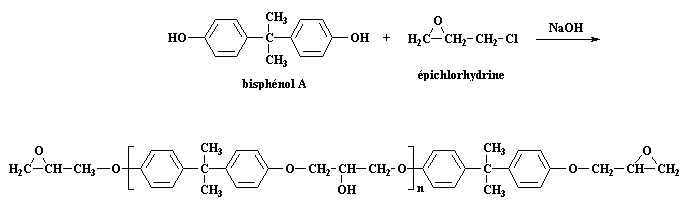
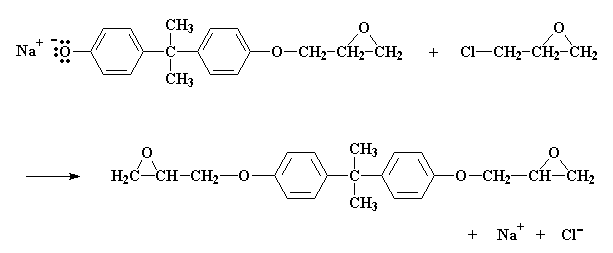
Alors comment cette réaction se fait elle? D'abord le NaOH va faire un petit échange avec le bisphénol A, pour donner le sel de sodium de bisphénol A:
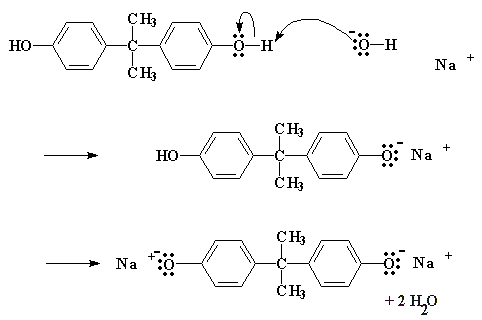
Cliquer ici pour voir un film de cette réaction.
Le sel comme vous l'avez noté, possède un oxygène avec une paire d'électrons qu'il ne partage avec personne. Normalement ce genre d'atome d'oxygène est généreux, et il veut partager ses électrons avec des atomes moins gatés. Alors il trouve un atome de carbone sur l'épichlorhydrine la plus proche qui peut utiliser quelques électrons. Cet atome est le carbone juste à côté du chlore. Ce chlore est supposé partager une paire d'électrons avec ce carbone, mais il tend à accaparer cette paire et devient alors électronégatif.
L'oxygène devient alors cette sorte d'atome qui donne une paire de ses électrons au carbone. Le carbone ne peut, bien sûr, mettre en partage que quatre paires d'électrons en même temps, donc une paire doit s'en aller s'il veut prendre la paire d'électrons de l'oxygène. Il laisse donc partir les électrons qu'il avait partagés avec le chlore, et il expulse le chlore hors de la molécule.
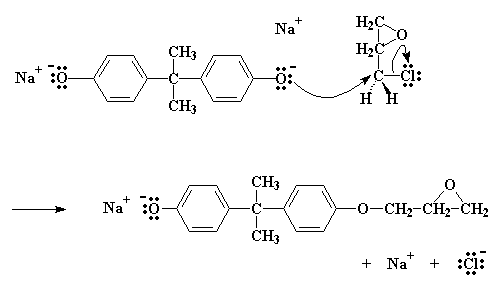
Cliquer ici pour voir un film de cette réaction.
Nous finissons avec une molécule similaire au bisphénol A, avec seulement un groupe époxy. Et nous avons aussi du NaCl.
Donc que se passe-t-il ensuite? Différentes choses peuvent se passer. Rappelez vous, sur la page époxy nous parlions de comment ces prépolymères peuvent être de différentes masses moléculaires. Quelques fois le degré de polymérisation atteint 25. Quelques fois il peut être aussi petit que ça:
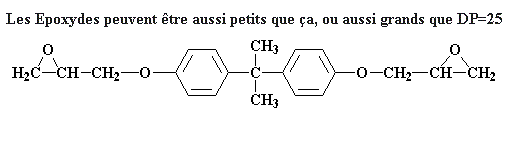
Voyons comment la taille du prépolymère dépend du ratio épichlorhydrine sur bisphénol A dans bain de réaction. Mettons ce ratio à deux molécules d'épichlorhydrine pour chaque molécule de bisphénol A. Regardons ce qui arrive pour cette molécule que nous venons de faire à ce ratio:
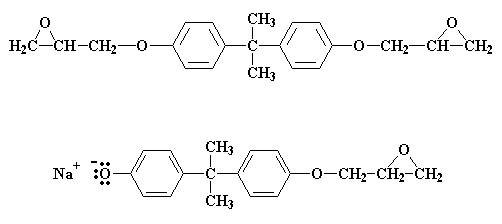
Ce qui arrive est que nous avons maintenant un groupe époxy de chaque côté. La réction s'arrête parce qu'il n'y a plus de groupe de sel de bisphenol A pour réagir.
Mais s'il y a moins de deux molécules d'épichlorhydrine pour chaque molécule de Bisphenol A ? Alors tous les groupements sels de bisphenol A ne pourrons réagir avec l'épichlorhydrine. Supposons maintenant que notre ratio est de trois molécules d'épichlorhydrine pour deux molécules de bisphenol A. Quand toutes les molécules d'épichlorhydrine ont réagi on reste avec un mélange 50:50 des deux types de molécules:
Ces deux molécules peuvent réagir ensemble pour donner cette
molécule: 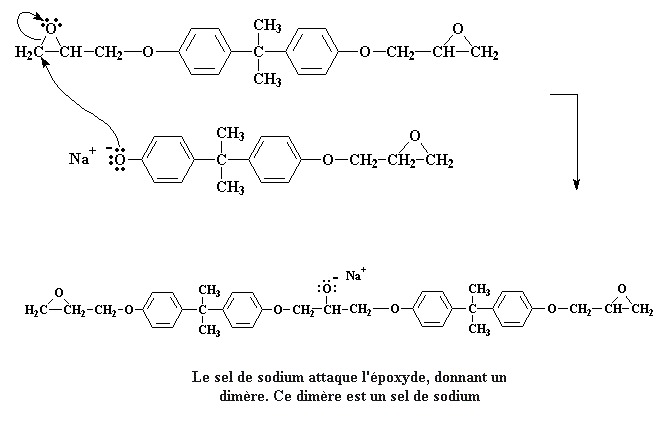
Cliquer ici pour voir un film de cette étape de la réaction.
On reste à présent avec un sel de sodium. Notez spécialement la charge négative sur l'atome d'oxygène. Quand une molécule d'eau arrive (rappelez-vous, nous avons fait des molécules d'eau quand nous avons fait le sel de bisphenol A), une paire d'électrons de l'atome d'oxygène va attaquer un des hydrogène de l'eau, et l'enlever à l'eau.
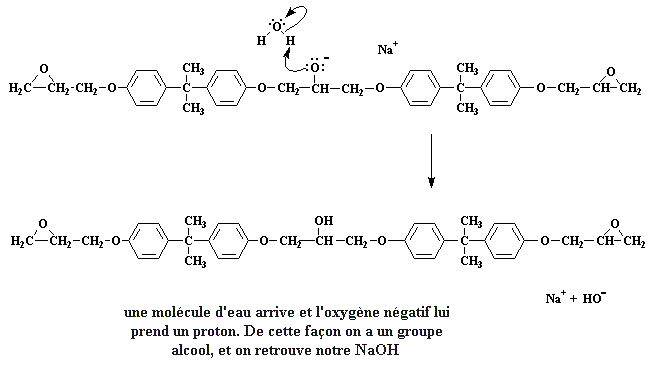
cliquer ici pour voir un film de cette étape de la réaction.
L'oxygène forme maintenant un groupe alcool et nous a rendu notre NaOH. Vous vous rappelez de NaOH?
Plus grande est la quantité d'épichlorhydrine par rapport à la quantité de bisphénol A, plus gros est l'oligomère obtenu. Pouvez-vous imaginer pourquoi? Quelle proportion devriez-vous utiliser pour obtenir un trimère.
Maintenant si vous voulez voir un film de tout le processus, cliquez ici.
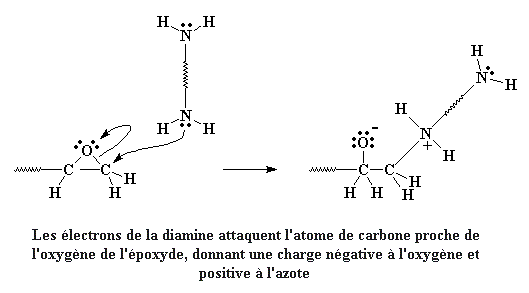
Une fois que vous avez vos prépolymères diépoxy, vous devez les attacher ensemble. On fait ça en ajoutant une diamine. La diamine fait quelque chose de drôle quand elle voit ces terminaisons époxy au bout du prépolymère. Les paires d'électrons isolées sur le goupe amine vont regarder ces goupes époxy, et elles vont voir que l'oxygène de l'époxy, électronégatif, aspire tous les électrons des atomes de carbone proches. Donc les électrons regardent ces atomes de carbone, et voient qu'ils peuvent facilement donner leurs électrons à l'atome de carbone de la fin de la molécule.
 cliquer ici pour
voir un film de cette étape de la réaction.
cliquer ici pour
voir un film de cette étape de la réaction.
Quand il fait ça, le carbone abandonne les électrons qu'il partage de facon inégale avec l'oxygène. La liaison entre le carbone et l'oxygène est cassée, et de nouvelles liaisons se forment entre le carbone et l'azote de l'amine. On reste avec une charge négative sur l'oxygène, et une charge positive sur l'azote.
Tout le monde a compris?
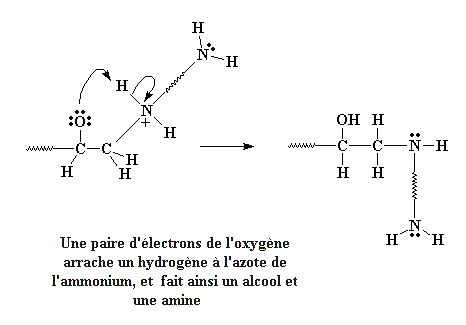
Jetons un coup d'oeil à l'oxygène. L'oxygène aime les électrons, mais il en possède trois paires qu'il ne partage pas avec un autre atome. Même l'oxygène sait que l'on peut avoir trop d'une bonne chose. Donc une paire de ces électrons non utilisée pour une liaison cherche quelque chose avec quoi se lier, et justement voilà qu'il trouve l'hydrogène lié à l'azote chargé positivement. Ces électrons attaquent donc cet hydrogène.
cliquer ici pour voir un film de cette étape de la réaction.
Quand ils attaquent, ils forment une liaison avec l'hydrogène, et l'hydrogène séparé de l'azote, laisse son électron derrière lui. Celui-ci s'occupera de la charge positive laissée sur l'azote central. Et bien sûr, l'oxygène est maintenant neutre aussi ayant gagné un proton, et il forme alors un groupe alcool.
Si cela vous dit de voir un film de l'ensemble du processus, cliquez ici.
Il reste encore un hydrogène sur le groupe amine, qui peut réagir avec un autre groupe époxy, exactement de la même façon. L'amine peut réagir avec autant de groupes époxy qu'elle a d'hydrogène.
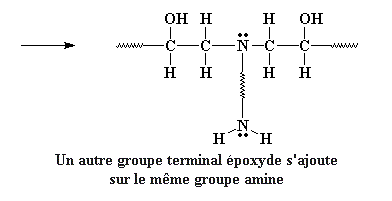
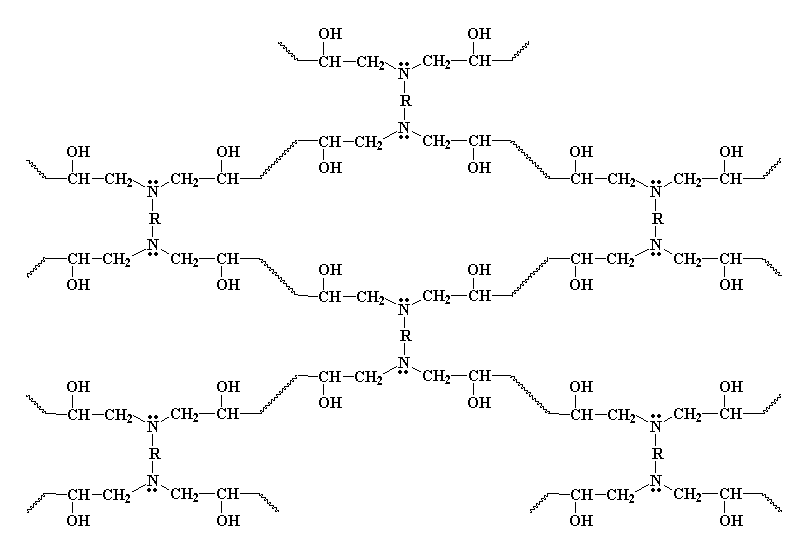
Rappelez-vous que nous utilisons une diamine, donc le groupe amine à l'autre bout de la diamine peut réagir de la même façon avec deux groupes époxy. Donc on finit avec quatre prépolymères époxy attachés à une molécule de diamine.
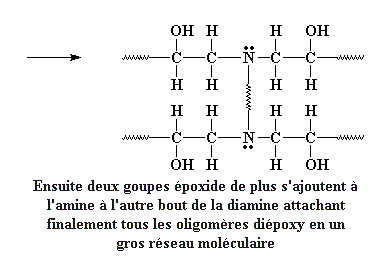
Rappelez-vous que les autres terminaisons des prépolymères diépoxy sont attachées à d'autres molécules diamines. De cette façon toutes les molécules de diamine s'attachent ensemble en une grosse molécule, un réseau réticulé. Ce réseau ressemble à ceci:
Copyright ©1995,1996
| Department of Polymer Science | University of Southern Mississippi