Parole chiave
anione
catione
complesso
legame covalente
ione
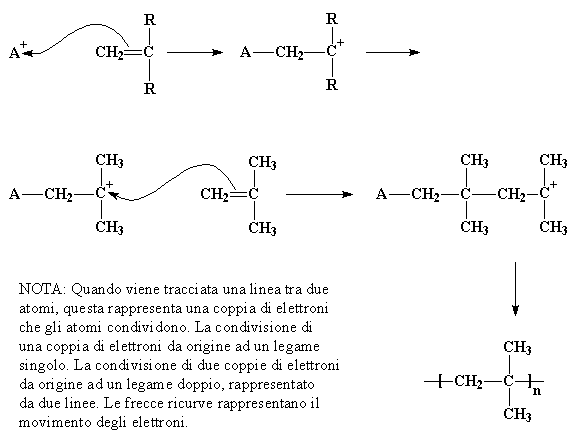
La polimerizzazione cationica vinilica è un metodo per ottenere i polimeri da piccole molecole, o monomeri, che contengono i doppi legami carbonio-carbonio. Il suo utilizzo commerciale primario è la realizzazione del poliIsobutilene.
Nella polimerizzazione cationica vinilica l'iniziatore è un catione, cioé uno ione con carica elettrica positiva. Viene rappresentato come A+ nella figura. Una coppia di elettroni, con carica negativa, sarà attratta dal doppio legame carbonio-carbonio verso questo catione facendo si che il doppio legame carbonio-carbonio formi un singolo legame con l'iniziatore, come mostra la figura. Così uno degli atomi di carbonio che forma il doppio legame rimane con meno elettroni del dovuto ed acquista una carica positiva. Questo nuovo catione reagirà con una seconda molecola di monomero nello stesso modo in cui l'iniziatore ha reagito con la prima molecola di monomero. Questo continua ad accadere fino a quando viene raggiunto un elevato peso molecolare, il peso molecolare con il quale il polimero diventa utilizzabile.

NOTA: Quando viene tracciata una linea tra due atomi, questa rappresenta una coppia di elettroni che gli atomi condividono. La condivisione di una coppia di elettroni da origine ad un legame singolo. La condivisione di due coppie di elettroni da origine ad un legame doppio, rappresentato da due linee. Le frecce ricurve rappresentano il movimento degli elettroni.<
Molte volte, però, inizia in un modo leggermente più complicato di quanto descritto prima. Normalmente l'iniziatore utilizzato può essere il tricloruro di alluminio, o AlCl3. Se conoscete la regola dell'ottetto saprete che tutti gli atomi della seconda fila della tavola periodica devono avere otto elettroni nel loro strato o livello elettronico più esterno. L'atomo di alluminio nel AlCl3 ha in comune la coppia di elettroni solo con tre altri atomi, lasciandolo solo con sei elettroni, ne mancano due per formare il magico ottetto. In questa condizione, rimane un'orbita (ossia, uno spazio vacante dove dovrebbe esserci una coppia di elettroni) completamente vuota e pronta a ricevere qualche composto che la occupi. Per fortuna, per la gioia dell'atomo di alluminio, una piccola quantità di acqua è sempre presente nel nostro sistema. L'atomo di ossigeno dell'acqua ha due coppie di elettroni liberi, e gentilmente ne dona una coppia all'atomo di alluminio, formando un complesso AlCl3 e H2O.
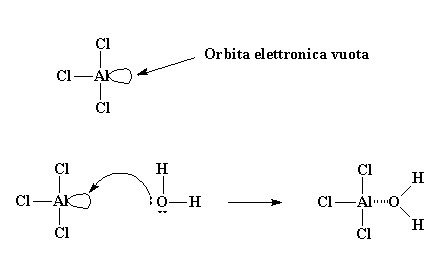
Orbita elettronica vuota
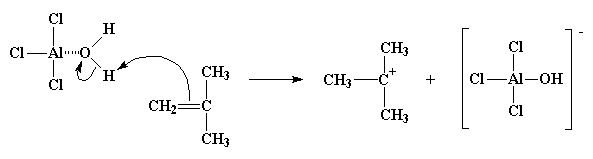
Poiché l'ossigeno è altamente elettronegativo tenderà ad attirare verso di sé gli elettroni che ha in comune con gli atomi di idrogeno, lasciando gli atomi di idrogeno con una carica positiva molto debole. In questo modo essi sono pronti per reagire con la coppia di elettroni del doppio legame di una molecola di monomero. Il monomero, in questo modo, può catturare un idrogeno, trasformandosi in catione, ed il complesso AlCl3/ H2O diventa il suo anione gratuito, AlCl3OH. Tutto questo processo con il quale il complesso AlCl3/ H2O si forma e reagisce con la prima molecola di monomero viene detto iniziazione.
Per vedere il filmato delle reazioni di iniziazione clicca qui
Dopo tutto questo abbiamo ottenuto un catione. Non un semplice catione, un carbocatione. Così viene chiamato un catione dove la carica positiva si trova sull'atomo di carbonio. I carbocationi sono molto instabili. Sono instabili perché l'atomo di carbonio del carbocatione ha solo sei elettroni nel suo strato più esterno. Sei! Ciò significa due elettroni in meno rispetto agli otto che tutti gli atomi di carbonio devono avere nel loro strato più esterno. Quindi un carbocatione farà di tutto per avere altri due elettroni e raggiungere il magico ottetto.
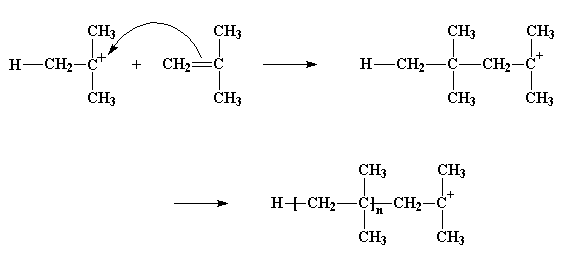
Il carbocatione si guarda intorno e trova una coppia di elettroni nel doppio legame di una molecola di monomero che passa di lì. (Ricordate, ci sono due coppie di elettroni nel legame doppio) Il carbocatione cattura questi elettroni, così facendo forma un legame singolo con la molecola di monomero. Genera anche un altro carbocatione, come potete vedere nella figura qui sotto. Questo può reagire con un altro monomero, e poi con un altro e un altro ancora e così via. Alla fine si ottiene una lunga catena polimerica.
Per vedere il filmato di questa reazione clicca qui
Questo processo con il quale un monomero si aggiunge a un monomero e così via per formare un polimero viene detto propagazione.
Ma come finisce tutto ciò? Come si arresta questo ciclo di aggiunta continua delle molecole di monomero per formare un polimero? Il metodo più utilizzato è questo� Immaginate una catena di poliisobutilene in crescita continua. I gruppi metilici legati all'atomo di carbonio cationico hanno qualche problema: hanno problemi di idrogeno. Gli atomi di idrogeno di questi gruppi metilici , senza troppa fatica, si allontaneranno per unirsi ad altre molecole. Questo è quello che può succedere quando capitano vicino ad una molecola di monomero di isobutilene. Affamati come sono di elettroni, essendo parte di un catione, questi atomi di idrogeno reagiscono facilmente con una coppia di elettroni del doppio legame carbonio-carbonio della molecola di isobutilene. Quando tutti gli elettroni stanno cercando di riorganizzarsi, come mostrato dalle frecce, abbiamo una catena polimerica neutra con un doppio legame nella parte finale, e un nuovo catione, formatosi dalla molecola di isobutilene. Ma il nuovo catione può dare inizio ad una nuova catena crescente, nello stesso modo in cui ha fatto la nostra molecola di iniziatore. Questo processo viene chiamato trasferimento di catena. Avviene anche nella polimerizzazione radicalica ed anche in altri tipi di polimerizzazione.
Questi atomi di idrogeno si allontanano per raggiungere altre molecole
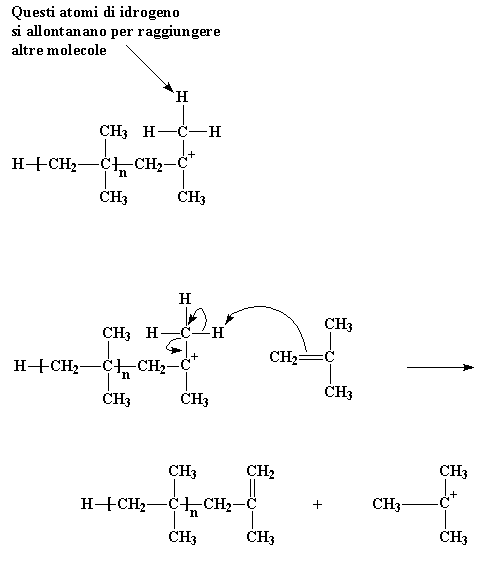
Per vedere il filmato di questa reazione clicca qui
Questo tipo particolare di trasferimento della catena viene chiamato trasferimento della catena verso un monomero. Ma esiste un altro tipo di trasferimento della catena. Per farvi capire è utile ricordare che per ogni catione c'è un anione appostato in qualche beaker! Ricordate quello ione AlCl3OH. Come sapete tutti, i cationi e gli anioni hanno il brutto vizio di reagire uno con l'altro, e questo può essere fastidioso quando vorremmo che il nostro catione reagisse con qualche cosa d'altro, ad esempio una molecola di monomero. Diamo un'occhiata a come avviene.
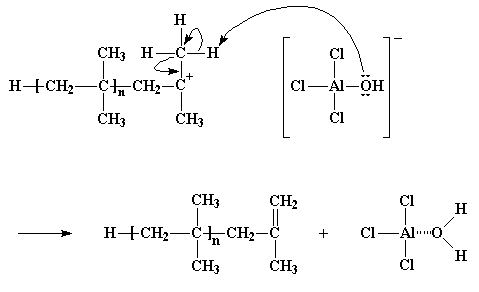
Per vedere il filmato di questa reazione clicca qui
Quando l'iniziatore cationico reagisce e forma una catena cationica in crescita, il vecchio anione dell'iniziatore cationico diventa l'anione del catione polimerico crescente. Ricordate che gli anioni tendono ad avere coppie di elettroni vaganti senza avere niente da fare e cosa dice sempre la mamma, mani oziose fanno il lavoro del diavolo? E' proprio quello che succede in questo caso. Gli elettroni dell'anione, prima o poi, reagiranno con gli atomi di idrogeno dei gruppi metilici vicini al carbonio cationico. Ricordate quegli atomi di idrogeno? Erano quelli così ansiosi di essere afferrati dalle molecole di monomero li vicine. Qualche volta, non spesso ma qualche volta, questi atomi di idrogeno reagiranno facilmente con gli elettroni non condivisi dell'atomo di ossigeno dell'anione nello stesso identico modo, lasciando la stessa catena di polimero senza vita con un doppio legame nella sua parte finale. Ma il lato positivo della cosa è che il complesso AlCl3/H2O viene rigenerato e può fare in modo che si formino nuovi polimeri proprio come ha fatto prima. Ecco un altro caso del malvagio trasferimento della catena.
Naturalmente non va sempre tutto bene. Talvolta reagisce la coppia di elettroni non condivisa di un atomo di cloro, e non con uno degli atomi di idrogeno, ma con lo stesso atomo di carbonio cationico. Abbandona il controione e si unisce al polimero. A questo punto rimane un altro polimero senza vita, che termina con un atomo di cloro, ed il composto AlCl2OH che non darà inizio ad un'altra catena in crescita di polimero.
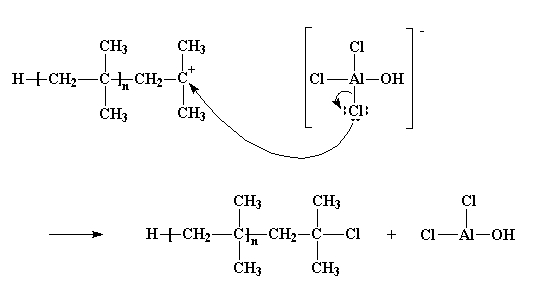
Per vedere il filmato di questa reazione clicca qui
Questo processo viene detto terminazione poiché non viene dato inizio ad alcuna catena. E' l'ultimo dei tre passaggi principali della polimerizzazione a catena, i primi due naturalmente sono la fase di inizio e la propagazione. Quando avviene la terminazione, la polimerizzazione finisce.

 Ritorna
all'Indice del Quarto Piano
Ritorna
all'Indice del Quarto Piano
 Ritorna
all'Indice della Macrogalleria
Ritorna
all'Indice della Macrogalleria