 Ключевые слова
Ключевые словаОдной наиболее роспространенной и наиболее полезной реакций для получения полимеров является радикальная полимеризация. Она используется для получения полимеров из виниловых мономеров, то есть из маленьких молекул, содержащих двойные углерод-углеродные связи. К числу полимеров, получаемых методом радикальной полимеризации, относятся полистирол, полиметилметакрилат, поливинилацетат и разветвленный полиэтилен. Но хватит введения. Что это за реакция и как она происходит?

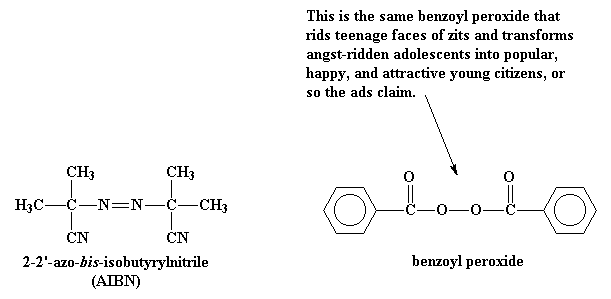
Весь процесс начинается с молекулы, называемой инициатором.
Это молекулы типа перекиси бензоила и
динитрила азодиизомасляной кислоты. Что в этих
молекулах такого особенного, так это то, что они имеют
странную привычку распадаться на составляющие, причем весьма
необычным образом. Когда они разваливаются, то пара электронов
в разрываемой связи разделяется. Это-то и необычно, поскольку
электроны любят держаться в парах, насколько это возможно.
Когда происходит этот распад, у нас остается от исходной
молекулы два обломка, которые называются
осколками инициатора. Каждый из этих осколков имеет
по одому неспаренному электрону. Молекулы такого типа, которые
имеют неспаренные электроны, называются
свободными радикалами.
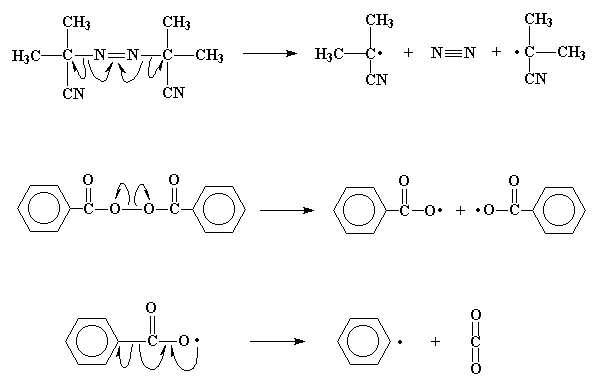
А теперь, как вы помните, эти неспаренные электроны будут
весьма недовольны своим одиночеством и будут стремиться
приобрести себе пару. Если им удается найти ЛЮБОЙ электрон, с
которым они могли бы образовать пару, они сделают это. Двойная
связь между атомами углерода в молекуле винилового мономера,
такого, как например, этилена, может быть весьма легко
атакована свободным радикалом. Неспаренный электрон, когда он
оказывается поблизости от пары электронов, не может избежать
искушения стащить для себя один из электронов. Эта новая
пара электронов образует новую химическую связь между осколком
инициатора и одним из атомов углерода в молекуле мономера,
который был связан двойной связью. Электрон, которому теперь
стало некуда податься, присоединяется к тому атому углерода,
который не связался с осколком инициатора. Вы видите, что это
приведет нас к той точке, из которой мы начинали движение.
Так как теперь у нас образовался новый свободный радикал,
неспаренный электрон осядет на том атоме углерода.
Весь этот процесс, распад молекулы инициатора с образованием
радикалов, последующее взаимодействие радикала с молекулой мономера,
называется фазой инициирования реакции полимеризации.
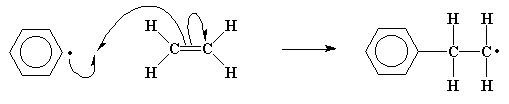
Знаете ли вы, что этот новый радикал может провзаимодействовать с еще одной молекулой этилена точно так же, как это произошло с осколком инициатора. Конечно же, как мы видим это мало что дает нам в плане спаривания электронов, поскольку у нас всегда по окончании реакции раз за разом образуется новый радикал.
Этот процесс добавления все новых и новых молекул мономера к растущей цепочке называется ростом макрорадикала.
Поскольку мы продолжаем каждый раз образовывать новый радикал,
то мы можем продолжать добавлять все новые и новые молекулы
этилена к растущей цепочки и достигать таким образом все
большей и большей ее длины. Самоподдерживающиеся реакции такого
типа называются цепными реакциями. Пока продолжается
рост цепочки, кого волнует, если несколько электронов остаются
неспаренными?
Но к сожалению, самим электронам до этого есть дело. Радикалы
нестабильны и, в конце концов, они могут найти способ сделать
свои электроны парными, не образовывая при этом новый радикал.
Тогда наша маленькая цепная реакция со скрипом остановится.
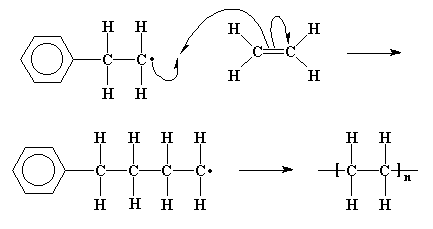
Это может произойти несколькими способами. Одним из самых
простых способов заключается в том, что два различных
макрорадикала находят друг друга. Если два таких неспаренных
электрона [на различных макрорадикалах] объединятся, образовав
тем самым пару, то образуется новая химическая связь,
соединяющая соответствующие цепочки. Это называется
рекомбинацией.
Рекомбинация яляется одним из самых распространенных реакций обрыва цепочки. Процесс обрыва является третьей и последней стадией цепной полимеризации. Конечно же, инициирование и рост цепочки являются первыми стадиями.
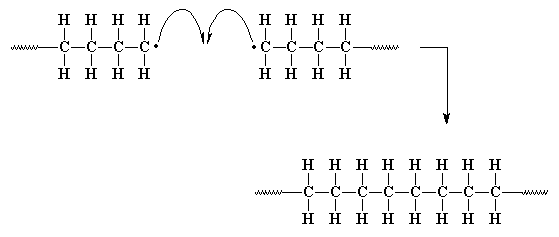
А вот появляется и еще одна реакция обрыва цепочки:
Другой способ, которым наши неспаренные электроны могут
прекратить реакцию полимеризации, называется
диспропорционирование радикалов. Это является
достаточно сложным и запутанным способом, которым две растущие
цепочки полимера могут решить свои проблемы неспаренных
электронов. При диспропорционировании, когда две растущие
цепочки оказываются рядом, неспаренный электрон одной цепочки
делает нечто странное. Вместо того, чтобы просто соединиться
с другим неспаренным электроном в другой цепочке, он ищет
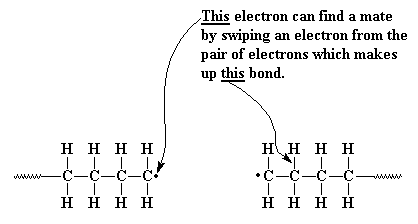
себе пару в другом месте. Он обнаруживает для себя связь между
атомом водорода и атомом углерода, стоящего в цепочке
рядом с другим атомом углерода, входящим в состав
радикальной группы. Наш неспаренный электрон хватает не
только электроны из этой связи, но заодно с ним и сам атом
водорода. Теперь у нашей цепочки больше нет неспаренных
электронов, а атом углерода на конце цепочки теперь делит
восемь электронов, так что все счастливы.
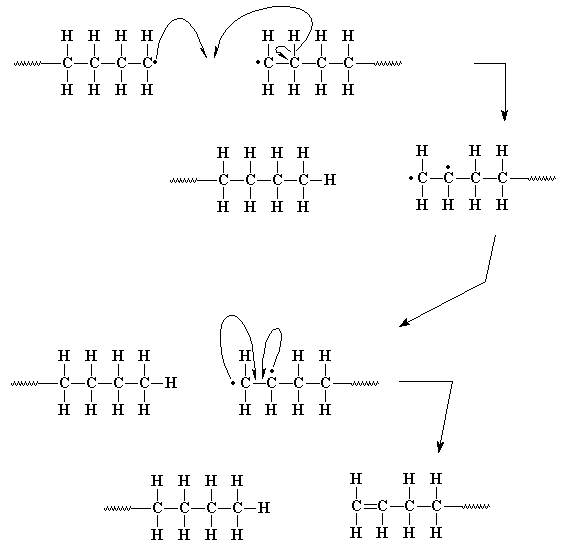
Когда мы говорим, что все довольны, то мы забываем про цепочку
полимеров, которая потеряла один из своих атомов водорода. Так
что теперь у нее не один атом углерода с неспаренными
электронами, а два! Это выглядит грустно, но на самом деле
проблема не так сложна как это кажется на первый взгляд. Два
углеродных радикала, расположенные прямо друг напротив друга
могут легко соединить свои неспаренные электроны, образовав тем
самым пару и в результате этого - химическую связь между двумя
атомами углерода. Но эти два атома уже делили между собой одну
пару электронов, так что вторая пара электронов образует
двойную связь на конце цепочки полимера.
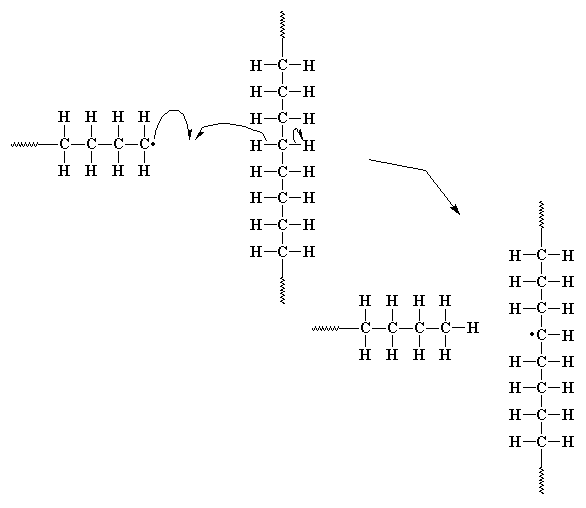
Иногда неспаренный электрон на конце растущей цепочки
настолько несчастен, что он образует пару с электроном из
углерод-водородной связи в средней части основной цепи
другой растущей макромолекулы. Тогда остается неспаренный
электрон, расположенный совсем не близко от растущего
конца цепочки. Этот электрон не может образовать двойную связь
таким же способом, как это сделал электрон из приведенного
выше примера, но зато он может провзаимодействовать с
молекулой мономера, так же как это ранее сделал осколок
инициатора (и он это сделает). Это взаимодействие приводит к
началу роста новой цепочки прямо из середины другой цепочки!
Этот процесс называется передачей цепи на полимер,
а в результате образуется полимер с разветвленной структурой.
Это является особенно большой проблемой при получении
полиэтилена, настолько серьезной, что
линейный неразветвленный полиэтилен не может быть получен
методом радикальной полимеризации.
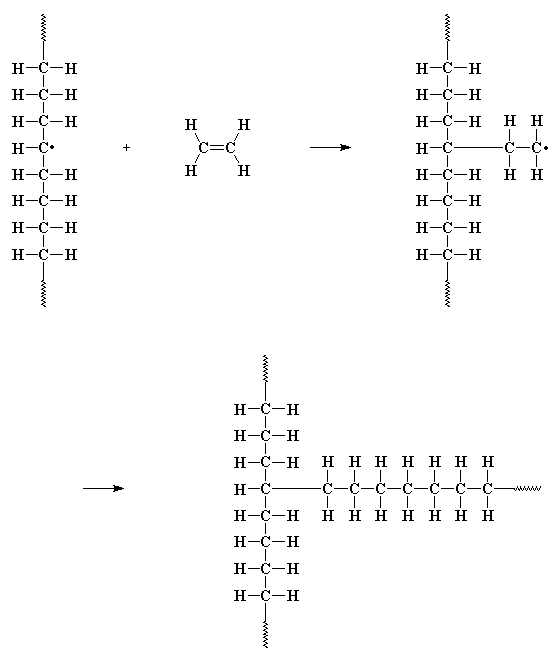
Это ветвление оказывает большое влияние на то, как ведет себя полиэтилен. Чтобы выяснить, как именно он себя ведет и как, избавивишись от образования разветвленной структуры, скромный полиэтилен смог стать лучше, чем Кевлар для применения его в пуленепробиваемых жилетах, посетите страницу о полиэтилене , полную развлечений и новой информации.
 Вернуться в директорию Четвертого Уровня
Вернуться в директорию Четвертого Уровня Вернуться
в основную директорию Макрогалереи
Вернуться
в основную директорию Макрогалереи