вторичное взаимодействие, гидродинамический объем
Полимеры, когда вы растворяете их в растворителе, делают нечто, а именно, значительно увеличивают вязкость раствора. Полимеры используются в качестве сгустителей в таких продуктах, как шампуни и даже мороженое. Этот эффект увеличения вязкости раствора может быть использован для оценки молекулярной массы полимеров. Сейчас самое время вам прочитать страницу молекулярная масса полимеров, если вы этого еще не сделали.Но прежде чем мы перейдем к более подробному обсуждению вопроса о молекулярной массе, давайте сначала зададим себе такой вопрос:
Почему полимеры увеличивают вязкость растворов?
Во-первых, полимеры движутся очень медленно, или по крайней мере, гораздо медленнее, чем маленькие молекулы. Это логично, что чем быстрее будут двигаться молекулы в жидкости, легче будет течь сама жидкость. Поэтому, когда мы растворяем полимер в растворителе, то их медленное движение делает весь раствор в целом более вязким.
Ответ - да, это действительно так. Полимеры довольно настырны. Им мало того, что они сами двигаются медленно, они чувствуют, что они должны заставить молекулы растворителя тоже двигаться медленнее. Итак, как же и почему макромолекулы упорно навязывают свои обычаи в общем более свободолюбивым молекулам растворителя? Ну ладно, макромолекулы двигаются медленно. Но почему весь раствор становится более вязким? Неужели молекулы полимера заставляют и молекулы растворителя тоже двигаться медленнее? Но как?
Чтобы понять это, стоит подумать о волшебных трехдневных выходных или праздниках. Вы уезжаете на праздники из города или собираетесь отправиться в путешествие на автомобиле с несколькими вашими самыми близкими друзьями - заговорщиками. Вы грузитесь в ваш блестящий скоростной автомобиль с открытым верхом и вырываетесь на шоссе в поисках приключений. Но вскоре после того, как вы вливаетесь в левый самый скоростной ряд вы замечаете, что ваш пульс заметно замедляется. Ветер, который столь бешено трепал вашу непокорную молодую шевелюру стихает до уровня легкого дыхания летнего ветерка по мере того, как падает ваша скорость. Ваш двигатель урчит на низких оборотах, и вам приходится переключаться сначала на четвертую передачу, потом на третью, чтобы не дать двигателю совсем заглохнуть на этой неправдоподобно низкой скорости. "Как же медленно!?" - думаете вы раздраженно, бросая взгляд на ваш спидометр, который теперь показывает жалкие сорок пять миль в час! (примерно семьдесят километров в час - прим. пер.)
И далеко впереди перед длинной цепочкой столь же медленно двигающихся скоростных машин с откидным верхом, все из которых тащатся на третьей скорости, вы замечаете запасное колесо в большом чехле, на котором написано: "Счастливая семья Хэтсонов (Hattsons) из Форестдейла, штат Висконсин (Forestdale, Wisconsin)". К этому чехлу для запасного колеса, оказывается, прикреплен громадный и угрожающий дом на колесах, весь бампер которого заклеен этикетками, отражающими богатую историю его путешествий в райские местечки для отпуска, такие как Гатлинбург, штат Теннесси (Gatlinburg, Tennessee) и Брэнсон, штат Миссури (Branson, Missouri). Этот дом на колесах, набитый счастливыми Хэтсонами, ползет себе потихоньку со скоростью, которая даже улитку заставит покраснеть от стыда. И вам приходится смириться с горьким разочарованием, и вы понимаете, что вы, по всей видимости, малость опоздаете в место своего назначения.
Точно так же происходит и в случае с молекулами полимеров и маленькими молекулами. Этот огромный и страшный дом на колесах, двигаясь медленно в левом скоростном ряду замедляет ВЕСЬ транспорт на шоссе. Точно так же медленно двигающиеся молекулы полимеров мешаются под ногами быстро двигающихся маленьких молекул, когда те пытаются течь. Поэтому и весь раствор начинает двигаться медленнее и становится более вязким.
И что еще хуже, молекулы полимеров не просто перегораживают линию движения маленьких молекул. Они также и замедляют их посредством межмолекулярных сил. Если существует какое-нибудь притягивающее вторичное взаимодействие между молекулами полимера и растворителя, то маленькие молекулы растворителя могут оказаться привязанными к молекулам полимера. Когда это случается, они начинают двигаться более или менее вместе с полимером, и конечно же, им приходится двигаться со свойственными полимеру маленькими скоростями. Чтобы лучше себе представить эту картину, можно подумать о маленьком астероиде, который летел на огромной скорости по космическому пространству, пока не был захвачен гравитационным полем большой планеты и не стал ее спутником. Точно таким же образом маленькая молекула растворителя, подойдя слишком близко к молекуле полимера будет захвачена и станет "спутником" молекулы полимера.
Этот эффект загустевания помогает вам оценить молекулярную массу благодаря простому факту: чем больше молекулярная масса, тем больше становится вязкость раствора. Это вполне логично. Когда у полимера более высокая молекулярная масса, он обладает и большим гидродинамическим объемом (то есть объемом, который закрученная в клубок молекула полимера занимает в растворе). Обладая большим размером, полимер может блокировать движения большего числа молекул растворителя. Можно сказать, что он перегораживает большее количество полос движения на шоссе. Кроме того, чем больше молекула полимера, тем сильнее вторичные взаимодействия. Вы помните принцип суммирования межмолекулярных сил? Поэтому, чем больше молекулярная масса, тем сильнее молекулы растворителя будут притягиваться к полимеру. Это усиливает замедление молекул растворителя. Ну ладно, полимеры делают растворы более вязкими. Ура. Но какое все это имеет отношение к вопросу об измерении молекулярной массы?
Для большинства полимеров существует вполне определенное соотношение между молекулярной массой и вязкостью. Поэтому, стоит измерить вязкость, и мы сможем получить молекулярную массу. И это как раз то, о чем пойдет речь в следующем разделе, об измерении вязкости раствора полимера.
Наконец...
Как же мы измеряем вязкость раствора полимера? На самом деле, это весьма просто. Мы просто берем забавного вида трубку, которая выглядит так же, как и та, что изображена на рисунке, и измеряем, сколько времени пройдет, прежде чем через нее протечет определенный объем жидкости.
Мы измеряем вязкость раствора полимераЧтобы убедиться в том, что мы каждый раз измеряем время, соответствующее одному и тому же объему, мы измеряем время, за которое объем жидкости падает от одной отметки (обозначенной на рисунке буквой a) до другой черты (отмеченной буквой b). Большое утолщение на трубке между двумя линиями сделано для того, чтобы увеличить объем жидкости между ними. Без этого утолщения уровень раствора понижался бы настолько быстро, что его было бы невозможно померить при помощи простого секундомера. 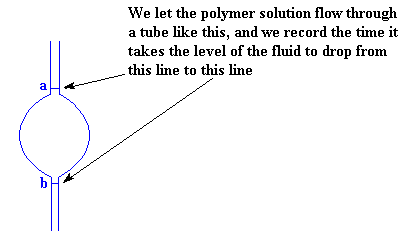
Итак, теперь мы знаем, как измерять время, которое требуется для того, чтобы уровень жидкости упал на заданное расстояние. Это время называется временем истечения. Сейчас я вам расскажу еще о некоторых подробностях. Мы не ограничиваемся одним измерением. Мы измеряем времена истечения для различных концентраций растворов нашего полимера. Мы также измеряем для сравнения время истечения чистого растворителя, в котором полностью отсутствует растворенный полимер.
Итак, что же мы теперь делаем с этими числами? Первое, что мы сделаем, - это дадим каждому из них свое название. Сначала мы назовем время истечения для чистого растворителя t0. А затем мы приступим к некоторой возне с числами. Первое, что мы вычислим - это отношение вязкости растворов полимеров к вязкости чистого растворителя. Мы получим его, поделив время истечения раствора полимера при данной концентрации (которое мы называем t) на t0, время истечения для чистого растворителя. Это даст нам то, что мы называем относительной вязкостью. Для обозначения этой величины мы используем греческую букву h.
Мы конечно же используем величину относительной вязкости, но сначала мы еще немного повозимся с временами истечения. На этот раз мы не будем смотреть на отношение времени истечения при данной концентрации раствора ко времени истечения чистого растворителя. Теперь мы будем смотреть на отношение разности времен истечения для раствора и чистого растворителя ко времени истечения чистого растворителя. Понятно? Мы вычитаем время истечения чистого растворителя, t0 из времени истечения раствора t. Затем мы берем результат этого действия и делим его на t0. Мы называем этот результат удельной вязкостью. Вы все еще понимаете, о чем я говорю? Вот соответствующие уравнения: 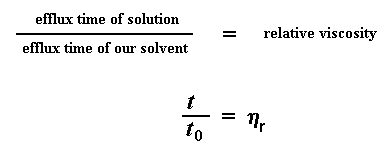
Теперь мы еще повозимся с удельной вязкостью. Мы поделим ее на соответствующую концентрацию растворителя и получим то, что называется приведенной вязкостью: 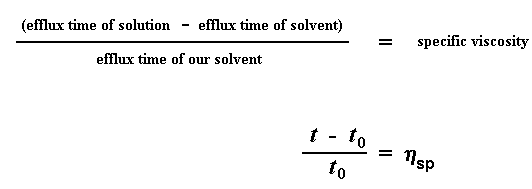
Вы, возможно, уже сообразили, что мы получим различные значения приведенной вязкости при разных концентрациях. (Вам придется проделать измерения для весьма большого числа различных концентраций в этом эксперименте.) Если мы отложим приведенную вязкость по оси y, а по оси x отложим концентрацию, мы получим график, который выглядит примерно вот так: 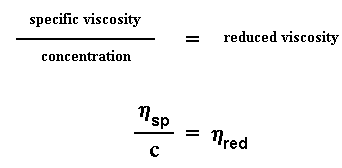
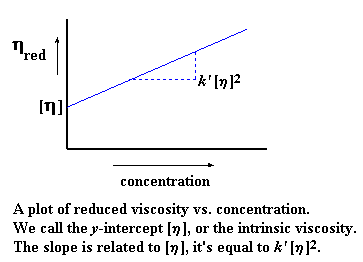
Когда мы строим этот график, то мы обозначаем тангенс угла наклона k'. Мы также экстраполируем этот график до нулевых значений концентрации и называем точку его пересечения с осью y характеристической вязкостью. (Характеристическая вязкость - это воображаемая величина. Поскольку вязкость меняется с концентрацией, то характеристическая вязкость определяется как гипотетическая вязкость при гипотетической "нулевой концентрации".) Подумайте об этом. Если вы еще не забыли основы алгебры из старших классов школы, то вы могли заметить, что таким образом мы получаем уравнение прямой в форме "тангенс угла наклона и смещение". Ну, вы помните, старые добрые y = mx + b, где m - это тангенс угла наклона, а b - это точка пересечения прямой с осью y:
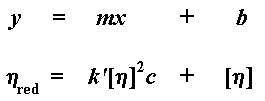
Конечно же, k' [h]2 - это и есть наше m, характеризующее наклон прямой. А [h] - это и есть b, точка пересечения с осью y. Характеристическая вязкость - это очень важная величина, поскольку именно она моментально даст нам значение молекулярной массы.
Но сначала, возможно, вам захочется сходить на перерыв, сделать легкий перекус, попить водички или чего-нибудь в этом роде прямо сейчас.
Вы вернулись? Ну разумеется, иначе бы вы все это сейчас не читали. Прежде чем мы перейдем к вычислению молекулярной массы по характеристической вязкости, я должен еще рассказать вам о другом способе расчета характеристической вязкости. Вы помните нашу старую добрую относительную вязкость? Я же говорил вам, что она нам еще пригодится! Именно ее-то мы сейчас и используем. Давайте возьмем натуральный логарифм относительной вязкости и поделим ее на величину концентрации раствора, для которого проводилось измерение. Это дает нам логарифмическую вязкость.

Точно так же, как и в случае приведенной вязкости, существует свое значение логарифмической вязкости для каждого измеренного значения концентрации. Поэтому давайте построим график логарифмической вязкости по оси y, а по оси x отложим концентрацию раствора. Тогда мы получим график примерно такого вида:
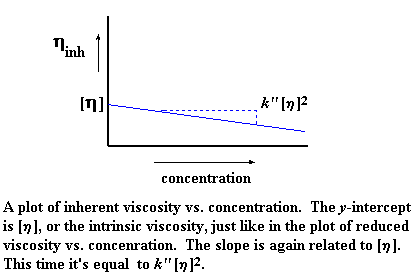
Как и прежде, [h] - это точка пересечения нашего графика с осью y, но угол наклона на этот раз у нас другой. На этот раз он равен k'' [h]2. Да, и на этот раз наш график задается тангенсом угла наклона и смещением по оси y. Хотите на него взглянуть? Вот он:
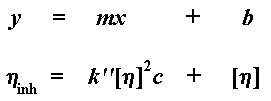
Мы обычно вычисляем нашу характеристическую вязкость, используя оба этих метода. Если их результаты совпадают, то мы знаем, что мы все сделали правильно. Мы обычно помещаем обе прямые на один рисунок, получая таким образом график, на котором две прямые встречаются в общей точке пересечения с осью y:
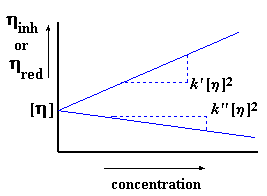
Другим способом определить, что все в порядке, является проверка равенства k' - k'' = 1/2.
Мы проделали уже огромную кучу операций с различными цифрами, но так пока и не получили значение молекулярной массы. Хоть когда-нибудь мы его получим?
Хорошо, хорошо, немножко терпения. Мне пришлось идти столь длинным кружным путем просто потому, что нам нужна характеристическая вязкость [h] для расчета молекулярной массы. Рассчитываем мы ее при помощи вот этого простого маленького уравнения:
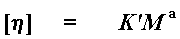
Оно называется уравнением Марка-Куна-Хаувинка (Mark-Houwink). M - это то, что мы называем вискозиметрической средней молекулярной массой (наконец-то!), а K' и a - это константы Марка-Куна-Хаувинка. Для каждого сочетания полимер - растворитель существует свой особый набор констант Марка-Куна-Хаувинка. Поэтому вам следует знать, с каким сочетанием полимер-растворитель вы имеете дело, чтобы точно определить молекулярную массу. Это также означает, что вы не можете таким методом получить точное значение молекулярной массы для полимера, который вы только что изобрели и для которого неизвестен набор констант Марка-Куна-Хаувинка. Но тем не менее этот метод может дать вам качественную оценку того, велика молекулярная масса или мала. Уже сам факт наличия характеристической вязкости может сказать вам о многом. Иногда это единственный способ сказать, является ли на самом деле полученное вами вещество полимером или нет.
Одно последнее замечание: для проведения такого рода экспериментов вам надо использовать сильно разбавленные растворы. Если раствор слишком концентрированный, то молекулы полимера могут сблизиться друг с другом настолько, что начнут взаимодействовать между собой. Это взаимодействие приводит к тому, что вязкость раствора начинает возрастать таким образом, который плохо описывается нашими уравнениями, поэтому получение точных данных становится невозможным. Вот почему этот метод называется вискозиметрией в разбавленных растворах.
Вы хотите узнать о других способах измерения молекулярной массы? Тогда посетите вот эти страницы!

 Вернуться в директорию Пятого Уровня
Вернуться в директорию Пятого Уровня