amorfo, cristal, transición de primer orden
temperatura de transición vítrea, capacidad calorífica, calor latente
transición de segundo orden, transición térmica
Nota: Antes de leer esta página, asegúrese a haber leído la página de transición vítrea y la página de la cristalinidad en los polímeros.
La calorimetría diferencial de barrido es una técnica que empleamos para estudiar qué ocurre cuando un polímero es calentado. La usamos para analizar lo que llamamos las transiciones térmicas de un polímero. ¿Y qué son las transiciones térmicas? Son cambios que tienen lugar en un polímero cuando usted lo calienta. La fusión de un polímero cristalino es un ejemplo. La transición vítrea es también una transición térmica.¿Pero cómo estudiamos lo que le sucede a un polímero cuando lo calentamos? El primer paso es obviamente calentarlo. Y luego viene lo que hacemos por medio de la calorimetría diferencial de barrido (del inglés, DSC).
Calentamos nuestros polímeros en un dispositivo similar a éste:
Es realmente muy simple. Tenemos dos platillos. En uno de ellos, el de la muestra, colocamos la muestra polimérica. El otro es el platillo de referencia. Lo dejamos vacío. Cada platillo se apoya sobre la parte superior de un calefactor. Luego le ordenamos a la inteligente computadora que ponga en funcionamiento los calefactores. De modo que la computadora enciende los calefactores y les dice que calienten los platillos a una velocidad específica, generalmente a 10 oC por minuto. La computadora se asegura totalmente de que la velocidad de calentamiento sea exactamente la misma a lo largo de todo el experimento. 
Pero lo que es más importante, se asegura de que los dos platillos separados, con sus dos calefactores separados, se calienten a la misma velocidad.
¿Cómo? ¿Por qué deben calentarse a la misma velocidad? La razón es que los dos platillos son diferentes. Uno contiene un polímero y el otro no. La muestra polimérica implica que hay material extra en el platillo de la muestra. Y tener material extra significa que hará falta más calor para lograr que la temperatura del platillo de la muestra, aumente a la misma velocidad que la del platillo de referencia.
De modo que el calefactor situado debajo del platillo de la muestra, debe trabajar más intensamente que el calefactor que está debajo del platillo de referencia. Tiene que suministrar más calor. Lo que hacemos en una experiencia de DSC, es medir cuánto calor adicional debe suministrarse.
Y lo hacemos del siguiente modo: Trazamos una curva a medida que la temperatura se incrementa. Sobre el eje x graficamos la temperatura. Sobre el eje y la diferencia de producción de calor entre los dos calefactores, a una dada temperatura.
Capacidad Calorífica
Podemos aprender mucho a partir de este gráfico. Imaginemos que estamos calentando un polímero. Cuando comenzamos a calentar los dos platillos, la computadora registrará la diferencia de producción de calor entre los dos calefactores versus temperatura. Esto significa que estamos graficando el calor absorbido por el polímero en función de la temperatura. Al principio, la curva se verá así:

El flujo de calor a una dada temperatura nos puede decir algo. El flujo de calor va a ser expresado en unidades de calor q, suministrado por unidad de tiempo, t. La velocidad de calentamiento es el incremento de temperatura T, por unidad de tiempo, t. ¿Se entiende?
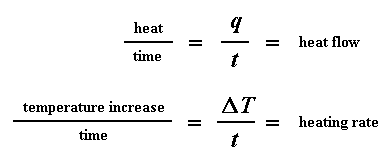
Si ahora dividimos el flujo de calor q/t por la velocidad de calentamiento T/t, tendremos calor suministrado dividido por el incremento de temperatura.
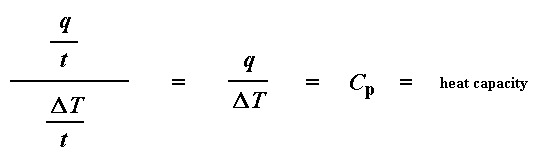
De acuerdo a lo visto en la página de la transición vítrea, recuerde que cuando agregamos una cierta cantidad de calor a algo, su temperatura se incrementará en una cierta cantidad y que la cantidad de calor necesaria para producir ese determinado incremento se llama capacidad calorífica, o Cp. Obtenemos la capacidad calorífica dividiendo el calor suministrado por el incremento resultante de temperatura. Y eso es justamente lo que hicimos en esa ecuación de más arriba. Es decir que hemos deducido la capacidad calorífica a partir del gráfico de DSC.
La Temperatura de Transición Vítrea
De hecho, mediante DSC podemos averiguar mucho más que la capacidad calorífica de un polímero. Veamos qué ocurre cuando calentamos el polímero un poco más. Luego de una cierta temperatura, nuestra curva dará un brusco salto hacia arriba, como éste:
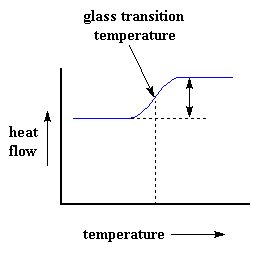
Esto quiere decir que ahora estamos teniendo un mayor flujo de calor. También significa que hemos obtenido un incremento en la capacidad calorífica de nuestro polímero. Esto sucede porque el polímero ha sufrido la transición vítrea. Y de acuerdo a lo que usted aprendió en la página de la transición vítrea, los polímeros poseen una mayor capacidad calorífica por encima de la temperatura de transición vítrea que por debajo. Debido a este cambio de capacidad calorífica que ocurre en la transición vítrea, podemos emplear la DSC para medir la temperatura de transición vítrea de un polímero. Usted puede apreciar que el cambio no ocurre repentinamente, sino que tiene lugar a través de un rango de temperaturas. Esto hace que resulte un poco complicado escoger una Tg discreta, pero generalmente tomamos como Tg el punto medio de la región inclinada.
Cristalización
Pero espere, porque hay más, mucho más. Por encima de la transición vítrea, los polímeros poseen una gran movilidad. Se contornean, se retuercen y nunca permanecen en una misma posición durante mucho tiempo. Son como esos pasajeros que intentan encontrar algún asiento cómodo en un avión y casi nunca lo consiguen. Cuando alcanzan la temperatura adecuada, han ganado la suficiente energía como para adoptar una disposición sumamente ordenada, que obviamente llamamos cristales.Cuando los polímeros se disponen en esos ordenamientos cristalinos, liberan calor. Y cuando este calor se pierde, el pequeño calefactor controlado por computadora que está bajo el platillo de la muestra, se pone contento. Está contento porque no tiene que suministrar más calor para hacer que la temperatura del platillo aumente. Esta caída en el flujo de calor puede verse como una gran depresión en la curva de flujo de calor versus temperatura:
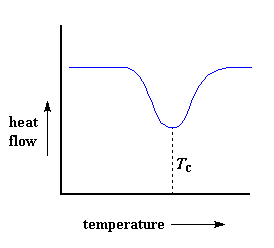
Esta depresión nos dice muchas cosas. La temperatura en el punto más bajo de la misma, se considera generalmente como la temperatura de cristalización del polímero, o Tc. También podemos medir el área de la depresión, lo cual nos dará la energía latente de cristalización del polímero. Pero, lo que es más importante aún, esta depresión nos dice que el polímero de hecho es capaz de cristalizar. Si analizáramos un polímero 100% amorfo, como el poliestireno atáctico, no obtendríamos ninguna depresión, ya que estos materiales no cristalizan.
Además, dado que el polímero entrega calor cuando cristaliza, decimos que la cristalización es una transición exotérmica.
Fusión
El calor puede permitir que se formen cristales en un polímero, pero si se suministra en demasía, puede causar su destrucción. Si seguimos calentando nuestro polímero más allá de su Tc, finalmente llegaremos a otra transición térmica que se denomina fusión. Cuando alcanzamos la temperatura de fusión del polímero, o Tm, los cristales poliméricos comenzarán a separarse, es decir, se funden. Las cadenas abandonan sus arreglos ordenados y comienzan a moverse libremente. Y en caso que se lo esté preguntando, podemos ver qué está sucediendo en la curva de DSC.¿Recuerda el calor que el polímero liberó cuando cristalizó? Bien, cuando alcanzamos la Tc, es hora de recuperarlo. Existe un calor latente de fusión, como así también un calor latente de cristalización. Cuando los cristales poliméricos funden, deben absorber calor para poder hacerlo. Recuerde que la fusión es una transición de primer orden. Esto quiere decir que cuando se alcanza la temperatura de fusión, la temperatura del polímero no se incrementará hasta que hayan fundido todos los cristales. O sea que el pequeño calefactor que está debajo del platillo de la muestra, deberá suministrar una gran cantidad de calor al polímero para fundir los cristales y para que la temperatura siga aumentando a la misma velocidad que lo hace la del platillo de referencia. Este calor extra durante la fusión aparece como un gran pico en nuestra curva de DSC, similar a éste:
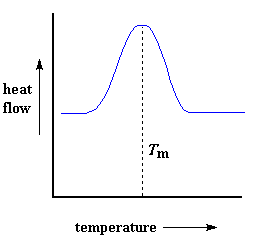
Podemos medir el calor latente de fusión midiendo el área de este pico. Y obviamente, consideramos la temperatura en la parte superior del pico como la temperatura de fusión del polímero, Tm. Puesto que hemos tenido que suministrar energía para que el polímero funda, decimos que la fusión es una transición endotérmica.
Poniendo Todo Junto
Hagamos un resumen: hemos visto un tramo de la curva en el cual el polímero fue calentado por encima de su temperatura de transición vítrea. Luego vimos una gran depresión cuando el polímero alcanzó su temperatura de cristalización. Y finalmente observamos un gran pico cuando el polímero alcanzó su temperatura de fusión. Si unimos todo, haciendo una curva completa, veremos algo así:


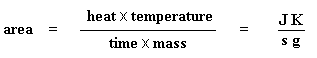

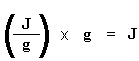
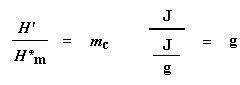
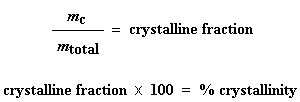
 Volver al Directorio del Nivel Cinco
Volver al Directorio del Nivel Cinco