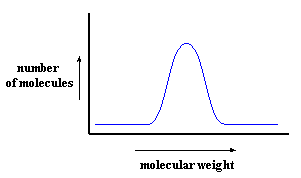
Una manera de obtener una curva como ésta es por medio de la cromatografía por exclusión de tamaño, o del inglés, SEC. Pero la SEC no mide en realidad peso molecular. Mide volumen hidrodinámico, es decir, el tamaño que tiene la cadena polimérica ovillada en solución. Esto nos da una medida relativa del peso molecular, porque obviamente, cuanto más alto sea el peso molecular del polímero, mayor será su volumen hidrodinámico.
Pero a veces necesitamos conocer exactamente cuál es la distribución del peso molecular. Por lo tanto, se dejó que científicos más inteligentes inventaran algo que llamamos espectroscopía de masa laser de desorción/ionización asistida por matriz, o del inglés, espectroscopía de masa MALDI. A veces nos ponemos demasiado perezosos y le decimos simplemente MALDI.
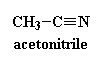 ¿Pero qué es esta fantástica cosa llamada MALDI? Para explicarlo, deberemos introducirnos en el proceso MALDI para ver cómo tiene lugar. Como primera medida, tomamos nuestro polímero y lo solubilizamos en un solvente. ¿Qué tipo de solvente? Depende. Las primeras experiencias MALDI fueron realizadas con
proteínas. Las proteínas tienden a ser solubles en agua, por lo tanto el agua fue el solvente primario. Era común emplear una mezcla 70:30 de agua y acetonitrilo (haga clic sobre su fórmula para verlo en 3-D). El solvente que usemos depende de qué clase de solvente disuelve el polímero que estamos estudiando.
¿Pero qué es esta fantástica cosa llamada MALDI? Para explicarlo, deberemos introducirnos en el proceso MALDI para ver cómo tiene lugar. Como primera medida, tomamos nuestro polímero y lo solubilizamos en un solvente. ¿Qué tipo de solvente? Depende. Las primeras experiencias MALDI fueron realizadas con
proteínas. Las proteínas tienden a ser solubles en agua, por lo tanto el agua fue el solvente primario. Era común emplear una mezcla 70:30 de agua y acetonitrilo (haga clic sobre su fórmula para verlo en 3-D). El solvente que usemos depende de qué clase de solvente disuelve el polímero que estamos estudiando.
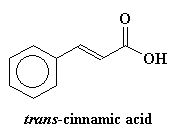
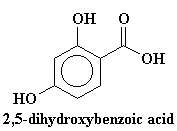
También agregamos un ingrediente especial. Y este ingrediente especial es un compuesto como el ácido trans-cinámico o el ácido 2,5-dihidroxibenzoico. Varía de polímero en polímero, pero lo importante es que nuestro ingrediente especial tiene que absorber la luz ultravioleta. Generalmente colocamos alrededor de 104 veces más de nuestro absorbente de UV que de polímero.

¿Alguien dijo laser? Sí, es correcto. En este momento, vamos a bombardear la muestra con un laser. Esto puede sonar no tan excitante para los más jóvenes, pero nosotros, los que crecimos antes de que los laser estuvieran tan difundidos, resulta sumamente asombroso. Generalmente empleamos un laser ultravioleta en el rango de 330-360 nm. Recuerde que la muestra ya posee incorporado un material que absorbe la radiación UV. Este material adora la luz UV y no puede saciarse. Por lo tanto absorbe toda la energía que puede del laser. De hecho, también transfiere algo de esa energía a las moléculas poliméricas.
El material de la matriz también reacciona con los polímeros de tal modo que éstos se transforman en iones cargados. Nadie sabe realmente cómo ocurre ésto. El hecho de que ahora los polímeros sean iónicos, será muy importante dentro de un momento.
Pero primero volvamos a toda esa energía que los polímeros están absorbiendo del material de la matriz. Cuando absorben toda esta energía, algunas moléculas poliméricas hacen cosas que los polímeros casi nunca hacen. Se evaporan. Por lo general las moléculas poliméricas son demasiado grandes y pesadas como para evaporarse, pero a temperaturas muy altas y a presiones bajas, pueden hacerlo. De ahí es donde viene la palabra desorción en el nombre del método.
Ahora, mientras tenemos nuestros polímeros flotando en estado gaseoso, es tiempo de contarle algo importante sobre esta cámara. En el extremo de la misma, donde estamos evaporando los polímeros, tenemos dos electrodos, un cátodo positivo y un ánodo negativo. Dependiendo de qué clase de polímero y qué clase de material de matriz estemos usando, los polímeros podrán ser cationes o aniones. Para esta explicación, diremos que el polímero que estamos estudiando forma cationes positivos.
Cuando evaporamos nuestro polímero, lo hacemos entre los dos electrodos. Si el polímero forma cationes, colocamos el cátodo positivo detrás de la muestra y el ánodo negativo delante de la muestra. (Observe otra vez el diagrama). De hecho, los polímeros cargados positivamente se desplazarán en la dirección del ánodo, atraídos por su carga negativa. Si lo hacemos correctamente, podemos emplear esta aceleración para dirigir las moléculas poliméricas hacia el detector, que se encuentra en el otro extremo de la cámara.
En su mayor parte, sólo hay una carga positiva en cada molécula polimérica. Esto significa que se aplica la misma fuerza eléctrica sobre cada molécula polimérica cuando está siendo acelerada en un campo eléctrico entre los dos electrodos. Pero recuerde que las moléculas poliméricas poseen distintas masas.
¿Qué dijo Isaac Newton sobre la masa, la fuerza y la aceleración? Creo que fue algo así:
F = ma
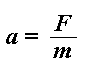
Por lo tanto los polímeros llegarán al detector, los más pequeños primero y luego los más grandes. Lo harán estrictamente de acuerdo a su masa. Todas las moléculas del mismo peso molecular llegarán juntas al detector. Cuando lo hacen, éste registra un pico. El tamaño del pico es proporcional al número de moléculas que llegaron simultáneamente. De modo que cuando terminamos, obtenemos una serie de picos que se ven así:
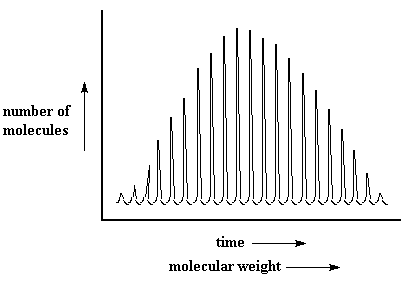
No sé qué piensa usted, pero ese espectro MALDI siempre me ha hecho acordar a la aleta gigante sobre el lomo del dimetredon, un reptil extinguido que vivió hace millones de años.

MALDI y SEC
Un pequeño detalle que usted puede apreciar, es que en este gráfico el peso molecular aumenta de izquierda a derecha. En un gráfico de SEC que usted ha visto más a menudo, el peso molecular aumenta de derecha a izquierda. (¿Puede deducir por qué?). Esto puede confundir las cosas a veces, de modo que téngalo en mente.Pero existen diferencias más importantes entre SEC y MALDI. La SEC nos da una distribución aproximada de peso molecular. Mide volumen hidrodinámico, no peso molecular. Podemos aproximarlo al peso molecular comparando el volumen hidrodinámico de un polímero estudiado con un standard, generalmente poliestireno, del cual conocemos la relación exacta entre volumen hidrodinámico y peso molecular. Esto sólo da un resultado aproximado porque la relación entre peso molecular y volumen hidrodinámico no siempre es la misma para cada polímero.
Pero la MALDI mide la masa en forma más precisa, porque no compara el polímero que estamos estudiando con otro. Da una medida absoluta de la masa. Con el tiempo, la MALDI probablemente reemplace a la SEC en la mayoría de los laboratorios.

 Volver al Directorio del Nivel Cinco
Volver al Directorio del Nivel Cinco