

Palabras clave:
complejo, ligando
Pero hay más que elevados pesos moleculares. También permite hacer polímeros con tacticidades muy específicas. Dependiendo de las necesidades, puede ponerse a punto para hacer polímeros isotácticos y sindiotácticos.
Sabía que no podría eludir indefinidamente esta pregunta. Podría decir simplemente, que la polimerización metalocénica es una polimerización catalizada por metalocenos.
Me imaginé que usted querría saberlo. Nuevamente, podría darle una respuesta simple, diciendo que un metaloceno es un ion metálico con carga positiva, entre medio de dos aniones ciclopentadienilo, con carga negativa.
¡Vaya mentes curiosas! ¡Y vuestra curiosidad no dejará de ser recompensada! Le diré que un anión ciclopentadienilo es un formidable pequeño ion formado a partir de una molécula llamada ciclopentadieno. Como estoy pensando que usted querrá preguntar qué es, debajo hay una figura del mismo:

Notará que existe un átomo de carbono con dos hidrógenos, mientras que el resto tiene sólo uno. Estos dos hidrógenos son ácidos, es decir, pueden desprenderse con facilidad. Cuando uno de ellos se va, abandona los electrones del enlace. De modo que el carbono que queda, tiene un par electrónico extra.
¿No cree que sería una incómoda situación tener electrones extra y no saber qué hacer con ellos?
Pero este no es el caso del ciclopentadieno. ¿Puede observar esos enlaces dobles en la molécula? Recuerde que cada uno de ellos tiene dos electrones, de modo que en total suman cuatro. Agréguele esos dos electrones de más sobre el carbono que perdió un hidrógeno y tendremos seis.
Esto es importante. Un anillo como éste con seis electrones, se volverá aromático. Si usted posee los suficientes conocimientos de química orgánica como para saberlo, ¡perfecto! Si no sabe lo que significa, el anillo en esta forma aniónica será sumamente estable.
¿Se entiende?
Estos iones ciclopentadienilo tienen carga -1, de modo que cuando aparece un catión como el Fe con carga +2, dos de los aniones formarán un "sandwich" con el hierro. Este "ferro-sandwich" se denomina ferroceno.
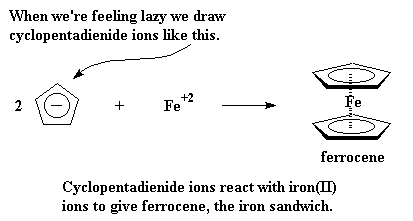
A veces se encuentra involucrado un catión de carga mayor, como el zirconio con carga +4. Para balancear la carga, el zirconio se unirá a dos iones cloruro, cada uno con carga -1, para dar un compuesto neutro.
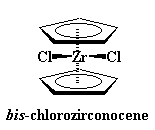
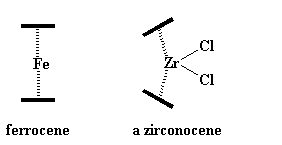
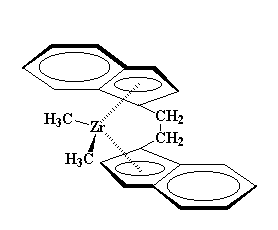
Los zirconocenos son un poco diferentes de los ferrocenos. Esos ligandos extras, los cloruros, ocupan un espacio. Resulta difícil para ellos deslizarse entre los anillos ciclopentadienilo. Por lo tanto, para hacerles lugar a los cloruros, los anillos se inclinan entre sí, abriéndose como el caparazón de una almeja. Esto les da a los cloruros, espacio para respirar. Observe ésto en la figura de abajo:
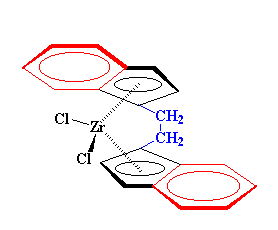
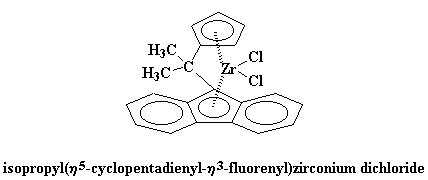
Podemos emplear algunos derivados del bis-clorozirconoceno para obtener polímeros. Por ejemplo, éste:
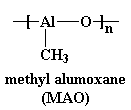
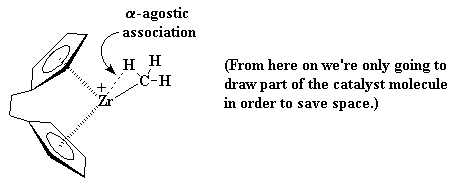
Aprender acerca del acomplejamiento alqueno-metal
Ir a la polimerización
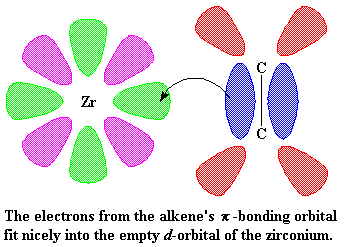
Veamos otra vez el zirconio. La figura nos muestra el zirconio y dos de sus orbitales d. En realidad, el zirconio posee cinco orbitales d, pero para mayor claridad, sólo mostraremos dos.
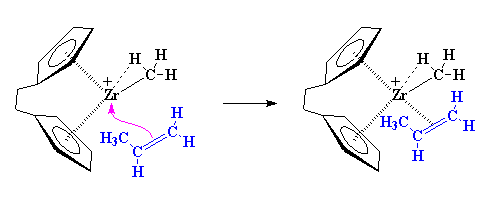
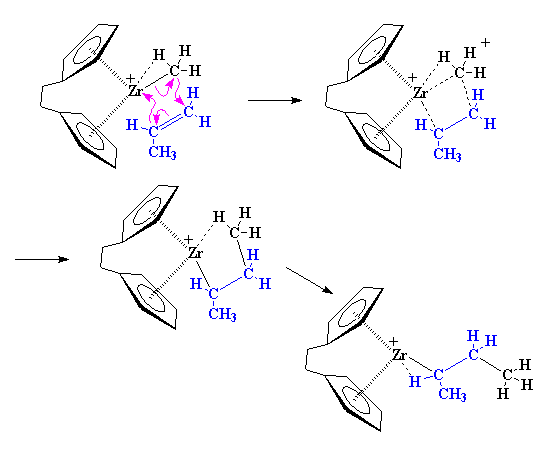
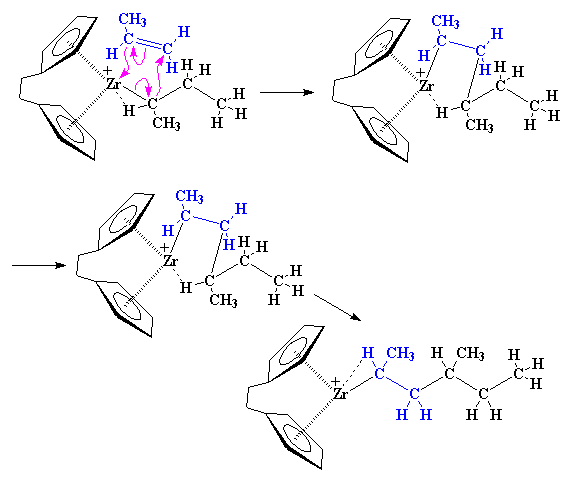
Volviendo adonde comenzamos, otro monómero propileno puede aparecer y reaccionar del mismo modo que lo hizo el primero.
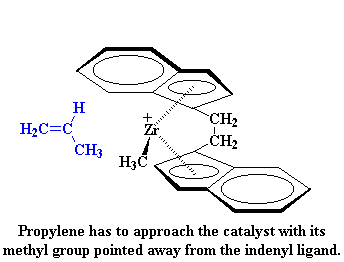
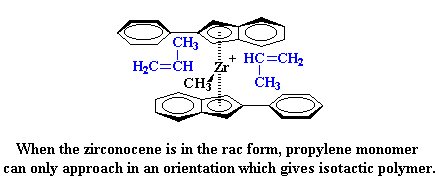
Pero entonces, ¿porqué obtenemos un polímero isotáctico? Fijémonos por un momento en el catalizador y en un monómero propileno entrante. Como puede apreciarse, el monómero propileno siempre se acerca al catalizador con su grupo metilo dirigido en el sentido opuesto del ligando indenilo.
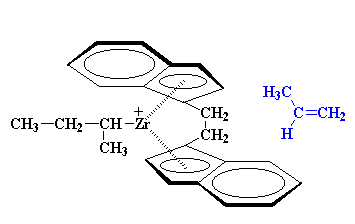
Cuando se agrega el segundo monómero, éste debe aproximarse desde el otro lado y también sus grupos metilo deben apuntar en sentido contrario a los anillos indenilo.
Bien, ésto nos lleva a una pregunta. Sabiendo que este catalizador nos conduce a polímeros isotácticos, ¿qué tipo de catalizador nos dará polipropileno sindiotáctico?
¿Lo adivinó? Es un catalizador como éste, que fue investigado por Ewen y Asanuma.
¿Qué significa ésto para nuestra polimerización? Significa que ocurrirá algo realmente extraño. Cuando el zirconoceno está en la forma rac, el monómero polipropileno sólo puede acercarse en una orientación que generará polipropileno isotáctico.
Complejos alqueno-metal
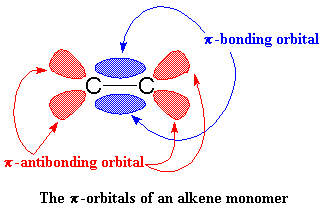
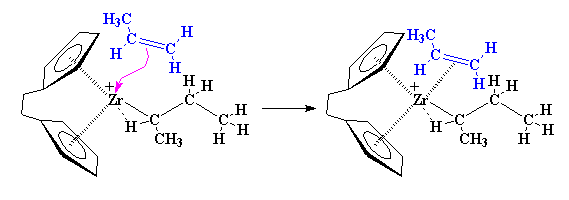
Aquí es donde ésto comienza a ponerse interesante. Supongamos que aparece un monómero vinílico, como por ejemplo, una molécula de propileno. El zirconio va a disfrutar de esta situación. Para entenderlo mejor, observemos el monómero vinílico, concretamente, su doble enlace. Un enlace doble carbono-carbono está constituido por un enlace s y un enlace p. Veamos más de cerca ese enlace p.


La Polimerización
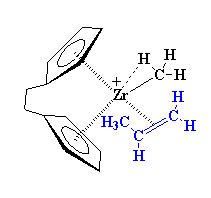
La naturaleza exacta del complejo entre el zirconio y el propileno es complicada. Para simplificar, de ahora en más vamos a representarlo tal como lo hicimos antes, es decir, así:
Crisis de Identidad
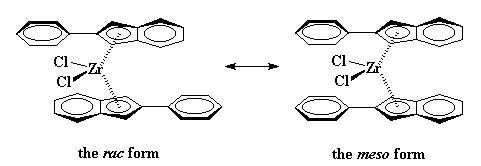
Sin embargo los catalizadores metalocénicos pueden hacer cosas más extrañas que esas. Consideremos el dicloruro de bis(2-fenilindenil)zirconio. Este metaloceno, como puede apreciarse debajo, no tiene un puente entre los dos anillos indenilo.
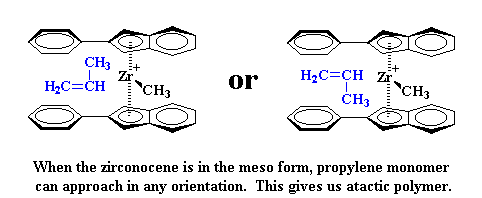
 Volver al Directorio del Nivel Cuatro
Volver al Directorio del Nivel Cuatro
 Volver al Directorio de Macrogalleria
Volver al Directorio de Macrogalleria