

Para comenzar, hacemos poliuretamos a partir de dos monómeros, un diol y un diisocianato. ¿Podemos ver cómo son? Sí, aquí están, justo debajo:
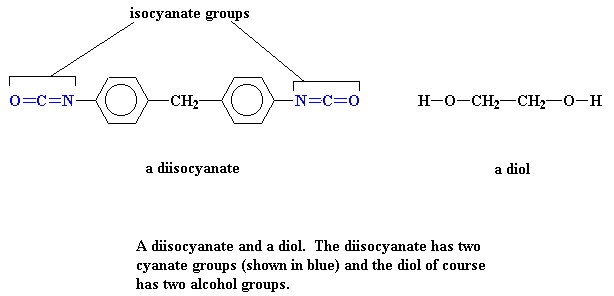
Si usted quiere, los podemos ver en 3-D haciendo clic aquí.
Con la ayuda de una pequeña molécula llamada diazobiciclo[2.2.2]octano, o DABCO, podemos lograr que ambos polimericen. Cuando mezclamos los dos monómeros en presencia de DABCO, ocurre algo interesante.
El DABCO es un muy buen nucleófilo, es decir, tiene un par de electrones no compartidos a quienes les encantaría atacar algún núcleo vulnerable. Recuerde que los electrones tienen cargas negativas y que los núcleos de los átomos tienen cargas positivas. Y todos sabemos que cargas negativas y positivas se atraen. Por lo tanto los electrones del DABCO miran a su alrededor y encuentran un núcleo en los hidrógenos alcohólicos del diol. Estos hidrógenos son vulnerables porque se encuentran unidos a átomos de oxígeno. El oxígeno es electronegativo. O sea que atrae hacia sí los electrones de otros átomos. Esto deja desbalanceada la carga positiva de sus núcleos. Los electrones que podrían balancear esa carga positiva con sus propias cargas negativas, fueron atraídos por el oxígeno. Por lo tanto quedó una ligera carga positiva sobre el hidrógeno.
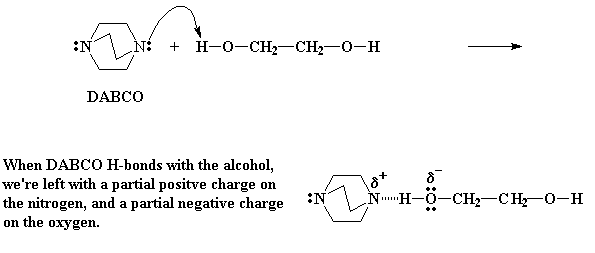
De modo que los electrones del DABCO observan ésto y no pueden evitarlo. Se apuran y forman un enlace por puente de hidrógeno entre el hidrógeno y el nitrógeno del DABCO. Este enlace por puente de hidrógeno deja una carga positiva parcial sobre el nitrógeno, y más importante aún, una carga parcial negativa sobre el oxígeno. Esta carga parcial negativa activa mucho más al oxígeno. Y siendo así, quiere reaccionar con cualquier cosa.
¿Quiere saber con quién va a reaccionar?
El oxígeno tiene un exceso de electrones, de modo que reaccionará con algo que se encuentre deficiente de electrones. Si observamos el isocianato, veremos que el carbono del grupo isocianato se sitúa justo en el medio de dos elementos electronegativos como el oxígeno y el nitrógeno. Esto quiere decir que dicho carbono se verá muy pobre en electrones. Por eso, el activo oxígeno no pierde tiempo y reacciona con él. Arroja un par de electrones sobre ese carbono y se establece un enlace.
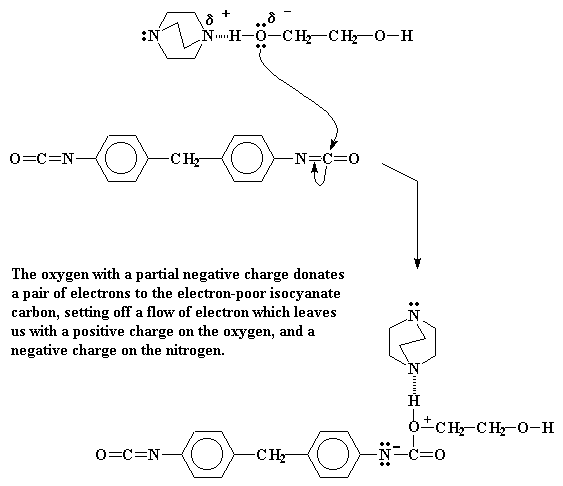
De hecho, ésto desplaza un par electrónico del doble enlace carbono-nitrógeno. Este par se sitúa sobre el nitrógeno, confiriéndole una carga negativa. Mientras tanto el oxígeno, que donó un par electrónico, quedará con una carga positiva.
No hay otra cosa peor para un átomo de nitrógeno, que portar una carga negativa. Por eso va a tratar de liberarse de ella en cuanto pueda. La manera más sencilla es donarle ese par a nuestro viejo amigo, el átomo de hidrógeno del alcohol. Esto forma un enlace entre ese hidrógeno y el nitrógeno.
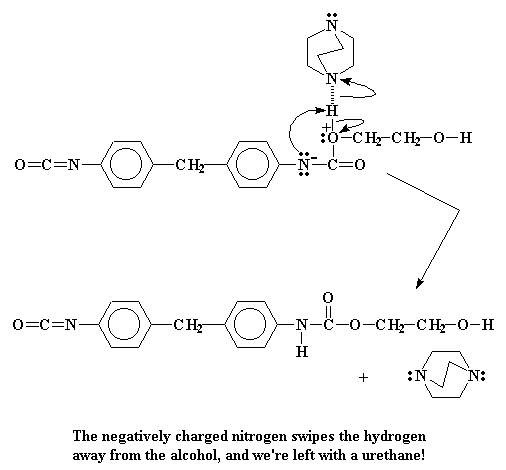
Los electrones que el hidrógeno había compartido con el oxígeno ahora pertenecen sólo al oxígeno. Esto elimina esa carga positiva que portaba el oxígeno. Cuando todo ésto termina, obtenemos una nueva clase de dímero de uretano.
Este dímero de uretano tiene un grupo alcohol en un extremo y un grupo isocianato en el otro, de modo que puede reaccionar ya sea con un diol o con un diisocianato para formar un trímero. O puede reaccionar con otro dímero, o un trímero, o aún oligómeros más grandes. De esta forma, monómeros y oligómeros se combinan y combinan hasta que obtenemos un poliuretano de alto peso molecular.
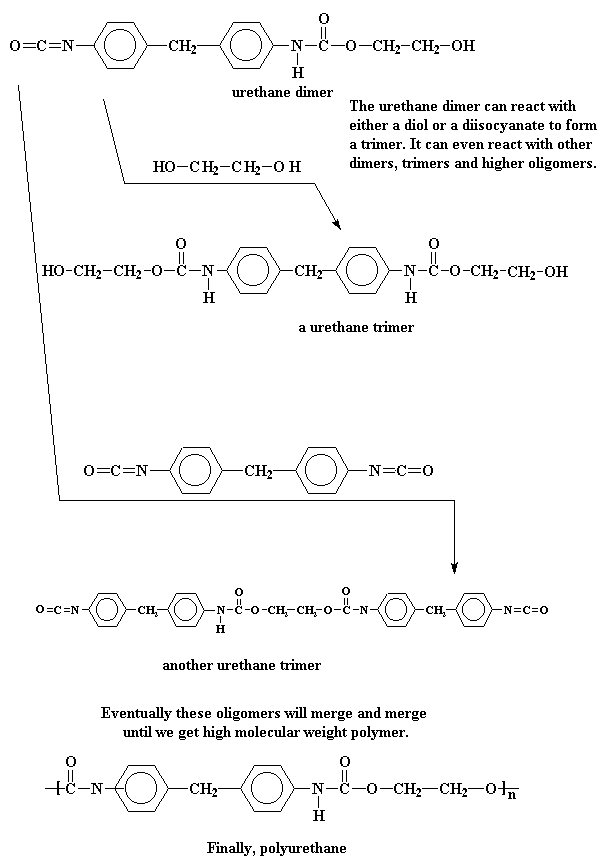
Aquéllos a quienes no se les escapa nada, notarán que no sólo reaccionan los monómeros, sino también los dímeros, trímeros y así sucesivamente. Esto nos habla de una polimerización por crecimiento en etapas. Además, debido a que no se producen pequeñas moléculas como subproductos, decimos que se trata de una polimerización por adición.
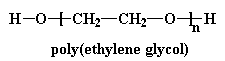
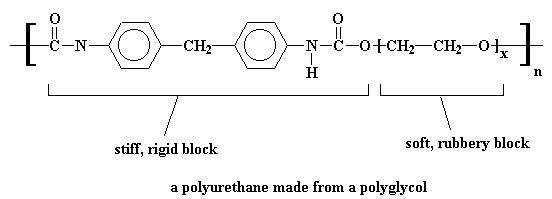
Esto nos conduce a un polímero dentro de otro polímero, por así decirlo, y obtenemos un poliuretano que se ve parecido a éste:
Si lo desea, puede aprender cómo obtener una espuma de poliuretano.
 Volver a la Página de los Poliuretanos
Volver a la Página de los Poliuretanos Volver al Directorio del Nivel Cuatro
Volver al Directorio del Nivel Cuatro Volver al Directorio de Macrogalleria
Volver al Directorio de Macrogalleria