

Mots clés
amorphes, cristal,
élastomère, thermoplastique
Avez-vous déjà laissé un seau en plastique ou un autre objet en plastique dehors pendant l'hiver, et vu qu'il se fissurait ou se cassait plus facilement qu'il ne le ferait pendant l'été? Alors vous avez fait l'expérience d'un phénomène appelé transition vitreuse. Cette transition est quelque chose qui n'arrive qu'aux polymères, et c'est une des choses qui rendent les polymères uniques. La transition vitreuse est beaucoup plus importante qu'elle ne le paraît. Il existe une certaine température (différente pour chaque polymère) appelée température de transition vitreuse, dont l'abréviation est Tg. Quand le polymère est refroidi en-dessous de cette température il devient dur et fragile, comme le verre. Certains polymères sont utilisés au-dessus de leur température de transition vitreuse , certains au-dessous. Les plastiques durs comme le polystyrène et le polyméthacrylate de méthyle sont utilisés au-dessous de leur température de transition vitreuse; ils sont à l'état vitreux. Leurs Tg sont bien au-dessus de la température ambiante, de l'ordre de 100 °C. Les caoutchoucs élastomères comme le polyisoprène et le polyisobutylène, sont utilisés au-dessus de leur température de transition vitreuse, c'est-à-dire à l'état caoutchouteux et ils sont mous et flexibles. Les plastiques souples comme le polyéthylène et le polypropylène sont aussi utilisés au-dessus de leur température de transition vitreuse.
A présent une petite mise au point. La transition vitreuse est différente de la fusion. La fusion se produit dans les polymères cristallins. La fusion est le passage des chaînes de polymère d'un état cristallin ordonné à un état liquide désordonné. La transition vitreuse se produit dans les polymères amorphes, c'est-à-dire des polymères dont les chaînes ne sont pas arrangées en cristaux ordonnés, mais sont disposées au hasard, de n'importe quelle façon, même si elles sont à l'état solide.
Mais même les polymères cristallins contiennent une partie amorphe. Cette partie représente en général entre 30 et 60% de la masse du polymère. C'est pourquoi un matériau polymère a à la fois une température de transition vitreuse et une température de fusion. Mais comme vous vous en doutez, la partie amorphe subit uniquement la transition vitreuse et la partie cristalline subit seulement la fusion.
Maintenant pour comprendre pourquoi les polymères désordonnés sont durs et fragiles en-dessous d'une certaine température et souples et ductiles au-dessus, cela peut vous aider de considérer les polymères à l'état amorphe comme une grande pièce remplie de serpents qui rampent. Chaque serpent est une chaîne de polymère. Comme vous le savez sans doute, les serpents sont des animaux à sang froid, donc toute la chaleur de leur corps doit venir de leur environnement. Quand il fait chaud les serpents sont heureux et peuvent ramper et glisser sans problème. Ils se déplacent partout au hasard, sur et autour des autres, et ils rampent çà et là juste pour s'amuser, du moins si on peut dire que les serpents s'amusent.
Mais quand il fait froid les serpents ne bougent plus autant. Sans chaleur, ils ralentissent et tendent à rester immobiles. Ils sont toujours emmêlés les uns aux autres; mais en ce qui concerne le mouvement il ne se passe plus rien.
A présent imaginez que l'on essaye de faire traverser à un bulldozer cette pièce pleine de serpents. Si il fait chaud, les serpents bougent et ils vont ramper hors du passage du bulldozer qui pourra traverser la pièce en causant un minimum de dommage aux serpents. Mais si il fait froid, deux choses peuvent arriver aux serpents immobiles: soit (A) les serpents sont plus forts que le bulldozer et le bulldozer ne pourra pas passer à travers et les serpents resteront là; soit (B) le bulldozer est plus fort que les serpents, et ils seront écrasés, mais ils ne bougeront pas.
Pour les polymères c'est pareil. Si la température est élevée, les chaînes de polymère bougent facilement. Donc quand vous prenez un échantillon de polymère et que vous le pliez, les molécules qui sont déjà en mouvement n'ont pas de problème pour se mettre dans une nouvelle position pour réduire la contrainte que vous leur avez appliquée. Mais si vous essayez de plier un échantillon de polymère au-dessous de sa température de transition vitreuse, les chaînes ne seront pas capables de se mettre dans de nouvelles positions pour réduire la contrainte. Et, comme dans l'exemple de la pièce de serpents, deux choses peuvent se produire: soit (A) les chaînes sont assez résistantes pour résister à la force appliquée, et l'échantillon ne se pliera pas, soit (B) la force appliquée est trop élevée pour que les chaînes résistent, et comme elles ne peuvent pas bouger pour réduire la contrainte, l'échantillon de polymère va casser ou voler en éclats dans vos mains.
Ce changement de mobilité avec la température se produit parce que le phénomène que nous appelons chaleur est en réalité une forme d'énergie cinétique; c'est-à-dire l'énergie des objets en mouvement. C'est en fait un effet du mouvement aléatoire des molécules, que ce soit les molécules de polymères ou les petites molécules. Les choses sont chaudes quand leurs molécules ont beaucoup d'énergie cinétique et bougent vite, et elles sont froides quand leurs molécules manquent d'énergie cinétique et bougent lentement ou pas du tout.
La température exacte à laquelle les chaînes de polymères subissent ce grand changement dans leur mobilité dépend de la structure du polymère. Pour voir comment un petit changement dans la structure peut amener un grand changement dans la température de transition vitreuse, regardez la différence entre le polyacrylate de méthyle et le polyméthacrylate de méthyle à la page des acrylates .
Il y a une différence entre les polymères et les serpents dont nous ferions mieux de parler tout de suite. Un serpent ne fait pas que se tortiller sur place, il va d'un bout à l'autre de la pièce. C'est ce qu'on appelle un mouvement de translation. Quand vous marchez dans la rue, en supposant que vous n'êtes pas comme tous ces gens qui ne marchent jamais, vous subissez un mouvement de translation. Bien que les polymères ne soient pas incapables d'un tel mouvement, en général ils ne font pas de translations. En revanche ils remuent sans arrêt, se tortillant par ci par là, un peu comme les enfants pendant la messe ou un accro de la nicotine qui n'a pas eu sa dose depuis trop longtemps. C'est sûr, quand il s'agit de la transition vitreuse, la température est trop basse pour que les macromolécules, emmêlées entre elles comme elles le sont, puissent parcourir quelque distance que ce soit dans aucune direction. Le mouvement qui permet à un polymère au-dessus de sa transition vitreuse d'être souple n'est pas un mouvement de translation, mais ce qui est connu dans le métier sous le nom de mouvement segmentaire à longue distance. Alors que la chaîne entière ne peut aller nulle part, les segments de la chaîne peuvent bouger, se balancer d'avant en arrière, et tourner comme un tire-bouchon. On peut considérer les échantillons de polymères comme une foule de gens sur une piste de danse. Alors que chaque personne tend à rester à la même place, de nombreux bras, jambes et ainsi de suite changent énormément de position. Quand la température descend en-dessous de la température de transition vitreuse, la partie est terminée pour les polymères et le mouvement segmentaire s'arrête. C'est à ce moment-là que se produit la transition vitreuse, et le polymère, de mou et souple, devient dur et fragile.
Pour être sûrs que tout cela soit clair, nous avons fait un petit film qui montre ce qui arrive aux chaînes de polymères au moment de la transition vitreuse. Cliquez ici pour le regarder.
Vous voulez vous amuser un peu? D'abord demandez à votre professeur d'apporter un peu d'azote liquide en classe. Mettez cet azote dans un récipient en polystyrène expansé, et trempez-y des objets courants en matériau polymère, comme des élastiques ou des sacs plastiques. L'azote liquide, très froid, va refroidir les objets en-dessous de leur température de transition vitreuse. Essayez de plier votre élastique (prenez le avec une paire de pinces, vous pourriez avoir des engelures en le prenant avec vos doigts) et vous verrez qu'il va se casser! Super, hein? L'élastique se casse car il est en-dessous de sa température de transition vitreuse.
Si vous voulez savoir comment mesurer le point de fusion et la température de transition vitreuse, et aussi les chaleurs latentes de fusion, et les variations de capacité calorifique, allez voir la page extraordinaire qui traite d'une technique appelée calorimétrie différentielle!
Vous voulez en savoir plus sur cet étrange phénomène qu'est la transition vitreuse? Lisez ces petits chapitres!
Parfois un polymère a une Tg plus haute qu'on ne le voudrait. Ce n'est pas grave, il suffit de rajouter quelque chose appelé un plastifiant. C'est une petite molécule qui va aller se mettre entre les chaînes de polymère et les éloigner les unes des autres. On appelle ça augmenter le volume libre. A ce moment-là les chaînes peuvent glisser les unes sur les autres plus facilement, et peuvent se mettre en mouvement plus facilement que sans le plastifiant. De cette façon la température de transition vitreuse d'un polymère peut être abaissée pour obtenir un matériau plus souple et plus facile à travailler.
Au cas où vous vous demanderiez de quelles petites molécules il s'agit, en voici quelques unes utilisées comme plastifiants:
Avez-vous déjà senti "cette odeur de voiture neuve"? Ce n'est pas quelque chose que je sens très souvent avec l'argent que je gagne, mais cette odeur est le plastifiant qui s'évapore des parties en plastique de l'intérieur de la voiture. Au bout de plusieurs années si une quantité suffisante de plastifiant s'est évaporée votre tableau de bord ne sera plus plastifié. La Tg des polymères de votre tableau de bord va dépasser la température ambiante, et le tableau de bord va devenir fragile et se fissurer.
Il est tentant de considérer la transition vitreuse comme une sorte de fusion du polymère. Mais c'est un façon inexacte de considérer les choses. Il y a énormément de différences entre la transition vitreuse et la fusion. Comme je l'ai déjà dit, la fusion se produit dans les polymères cristallins, alors que la transition vitreuse se produit dans les matériaux amorphes. Un polymère donné aura souvent à la fois des domaines amorphes et cristallins, donc une température de fusion ET une température de transition vitreuse. Mais les chaînes qui fondent ne sont pas celles qui subissent la transition vitreuse.
Il y a une autre grosse différence entre la fusion et la transition vitreuse. Quand vous chauffez un polymère cristallin à une vitesse constante, sa température croît à une vitesse constante. La quantité de chaleur nécessaire pour augmenter la température d'un gramme de polymère de un degré Celsius est appelé capacité calorifique.
La température augmente jusqu'à ce que le polymère atteigne son point de fusion. Quand ceci se produit, la température reste constante pendant un moment même si vous continuez à ajouter de la chaleur au matériau. Elle reste constante jusqu'à ce que le polymère ait complètement fondu. Ensuite la température recommence à augmenter. L'augmentation de la température s'arrête car la fusion demande de l'énergie. Toute l'énergie que vous ajoutez à un polymère cristallin à son point de fusion sert pour la fusion et plus du tout pour augmenter la température. Cette énergie est appelée chaleur latente de fusion.
Maintenant que le polymère est fondu la température recommence à augmenter, mais elle augmente plus lentement. Le polymère fondu a une capacité calorifique supérieure au polymère solide cristallin, donc il absorbe plus d'énergie et la température augmente moins.
Donc deux choses se produisent quand un polymère cristallin fond: il absorbe une certaine quantité de chaleur, la chaleur latente de fusion, et il subit un changement dans sa capacité calorifique. Tout changement provoqué par la chaleur, que ce soit la fusion ou la solidification, l'ébullition ou la condensation, qui induit un changement de capacité calorifique, avec une chaleur latente impliquée, est appelé une transition du premier ordre.
Mais quand vous chauffez un polymère amorphe jusqu'à sa température de transition vitreuse, il se passe autre chose. D'abord vous le chauffez , et sa température augmente. Elle augmente à une vitesse déterminée par la capacité calorifique du polymère, juste comme tout à l'heure. Seulement quelque chose de drôle se passe quand on atteint Tg. La température n'arrête pas d'augmenter. Il n'y a pas de chaleur latente de transition vitreuse.
Mais la température n'augmente pas à la même vitesse au-dessous et au-dessus de Tg. Le polymère subit un accroissement de sa capacité calorifique quand il subit la transition vitreuse. Comme la transition vitreuse implique un changement de capacité calorifique, mais pas de chaleur latente, cette transition est appelée transition du second ordre.
Regardez ces belles figures. Les courbes montrent la quantité de chaleur ajoutée au polymère sur l'axe y et la température que vous obtenez avec une certaine quantité de chaleur sur l'axe x.
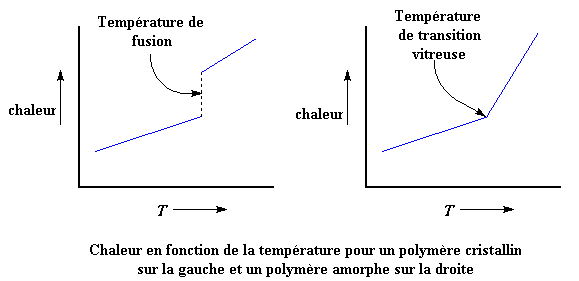
La courbe sur la gauche montre ce qui se passe quand on chauffe un polymère 100% cristallin. Vous pouvez voir que la courbe est discontinue. Cette discontinuité correspond à la température de fusion. A cet endroit beaucoup d'énergie est ajoutée sans aucune augmentation de la température. C'est la chaleur latente de fusion. On voit que la pente de la courbe est plus forte après la discontinuité. Cette pente est égale à la capacité calorifique, donc l'augmentation de la pente correspond à l'accroissement de la capacité calorifique au-dessus du point de fusion.
Mais sur la courbe de droite, qui représente ce qui arrive à un polymère 100% amorphe quand on le chauffe , il n'y a pas de discontinuité. Le seul changement que l'on voit à la transition vitreuse est une augmentation de la pente, ce qui correspond à un accroissement de la capacité calorifique. Comme je l'ai déjà dit, il n'y a pas de chaleur latente associée à la transition vitreuse. Et ceci, mes amis, juste sous vos yeux, est la différence entre un transition du premier ordre comme la fusion et une transition du second ordre comme la transition vitreuse.
Ok, nous savons maintenant que certains polymères ont de hautes Tg et que d'autre ont de basses Tg. Mais ce que nous avons oublié de nous demander, c'est pourquoi? Qu'est-ce qui fait qu'un polymère a une transition vitreuse à 100 °C et un autre à 500 °C?
La réponse très simple est : la facilité plus ou moins grande des chaînes à bouger. Une chaîne qui peut bouger facilement donnera un polymère avec une basse température de transition vitreuse, alors qu'un chaîne qui bouge difficilement donne un polymère à haute Tg. C'est logique. Plus les chaînes bougent facilement, moins on a besoin de fournir d'énergie pour que les chaînes commencent à remuer et sortent de l'état vitreux rigide pour entrer dans l'état caoutchouteux souple.
Donc on arrive à une autre question...
Je suis content que vous demandiez ça. Plusieurs choses affectent la mobilité des chaînes de polymères. Allez voir chacune d'elles!
C'est le plus important. Plus la chaîne principale est flexible, mieux le polymère bougera et plus la Tg sera basse. Prenons quelques exemples. Le plus dramatique est celui des silicones. Regardons le polydiméthylesiloxane.
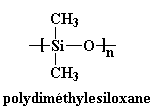
Sa chaîne principale est si flexible que le polydiméthylesiloxane a une Tg à -127 oC! Sa chaîne est si flexible qu'il est liquide à température ambiante, et il est même utilisé pour épaissir les shampoings et après-shampoings.
Maintenant regardons un autre extrême, la polyphénylène sulfone.
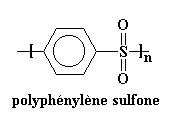
La chaîne principale de ce polymère est complètement raide. Elle est si rigide qu'il n'a pas de transition vitreuse! Vous pouvez chauffer cette chose jusqu'à plus de 500 °C, elle restera à l'état vitreux. Elle se décompose avant sa transition vitreuse. Pour avoir un polymère un tant soit peu possible à mettre en �uvre, il faut rajouter des groupes flexibles dans la chaîne principale. Les groupes éthers marchent bien.
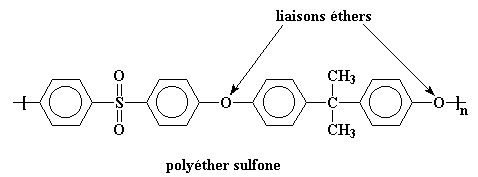
Ce type de polymère est appelé polyéther sulfone, et les groupes éther flexibles ramènent la Tg jusqu'à une température plus maniable de 190 oC.
Les groupes secondaires ont un gros effet sur la mobilité des chaînes. Même un petit groupe peut agir comme un hameçon qui accroche la molécule voisine lorsque le polymère essaye de bouger comme un tire-bouchon. Les groupes secondaires s'accrochent aussi les uns aux autres quand les chaînes essayent de glisser les unes sur les autres.
L'un des meilleurs groupes secondaires pour obtenir une haute Tg est le très volumineux groupe adamantyle. Un groupe adamantyle est dérivé d'un composé appelé adamantane.
Un gros groupe comme celui-ci agit plus que comme un simple hameçon qui attrape les molécules voisines et empêche le polymère de bouger. C'est carrément une ancre. Il n'attrape pas seulement les chaînes voisines, sa propre masse est une telle charge pour la chaîne à laquelle il appartient que cette chaîne bouge beaucoup plus lentement. Pour voir comment cela affecte Tg, regardons simplement deux polyéther cétones, une avec un groupe adamantane et l'autre sans.
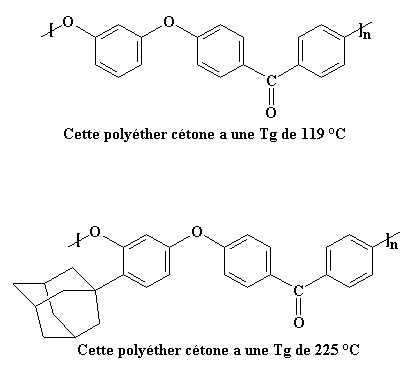
La Tg du polymère du haut, 119 °C, est déjà décente, mais le groupe adamantyle l'augmente jusqu'à 225 °C.
Mais des groupes secondaires volumineux peuvent aussi abaisser la Tg. Vous voyez, les gros groupes secondaires empêchent les chaînes de polymères de se rapprocher. Plus les chaînes sont loin les unes des autres, plus facilement elles peuvent bouger. Cela abaisse la Tg, de la même façon qu'un plastifiant. La manière élégante de dire qu'il y a plus de place entre les chaînes de polymère est de dire qu'il y a plus de volume libre dans le polymère. Plus il y a de volume libre, plus la Tg est basse en général. On peut le voir avec une série de polymères méthacrylate:

On peut voir une baisse notable de la Tg chaque fois que l'on rajoute un carbone sur la chaîne alkyle. On commence à 120 °C pour le polyméthacrylate de méthyle, mais quand on arrive au polyméthacrylate de butyle, la Tg a chuté jusqu'à 20 °C, environ la température ambiante.
Copyright ©1995,1996,1997 | Department of Polymer Science | University of Southern Mississippi