
Sleutelwoorde:
kompleks,
ligand
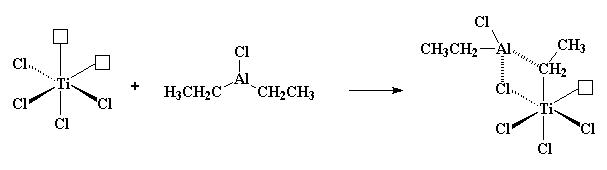
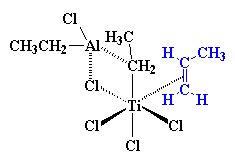
So, hoe werk dit dan? Dalk so... Vat jou Ziegler-Natta katalis, gewoonlik TiCl3 of TiCl4, saam met 'n aluminium gebaseerde ko-katalis, en sit dit in die monomeer om middernag as die maan vol is.... Nee! Dit is nie regtig hoe dit sal werk nie, maar ons kennis van presies hoe Ziegler-Natta polimerisasie werk, en hoekom een inisiëerder sisteem beter as 'n ander sal werk, is baie beperk. Om die regte kondisies te kies wat 'n Ziegler-Natta polimerisasie sal laat werk voel amper party dae soos towerkuns. Maar ons weet darem 'n bietjie. Ons weet dat dit 'n oorgangsmetaal katalis, soos bv. TiCl3, benodig. Verder weet ons ook dat daar 'n ko-katalis betrokke moet wees, en gewoonlik gebasseer op groep III metale soos aliminium. Meestal is die katalis/ko-katalis paar TiCl3 en Al(C2H5)2Cl, of TiCl4 met Al(C2H5)3.
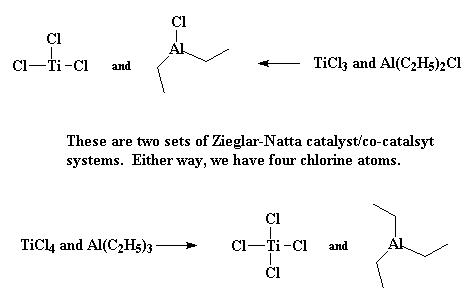
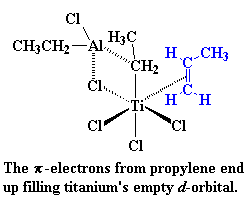
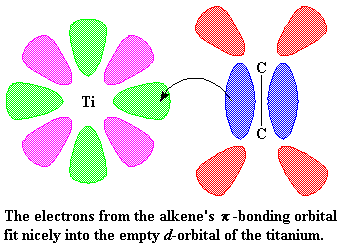
Op hierdie oomblik kom daar 'n vinielmonomeer soos propileen aan. Daar is twee elektron in die p-sisteem van die koolstof-koolstof dubbelbinding. Hierdie elektrone kan gebruik word om die leë orbitaal van die titaan te vul. Ons sê dus dat die propileen en die titaan 'n kompleks vorm, wat ons dan so voorstel:
Leer meer oor alkeen-metaal kompleksering
Reguit na die polimerisasie
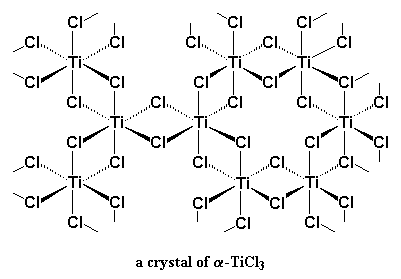
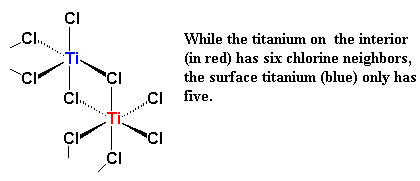
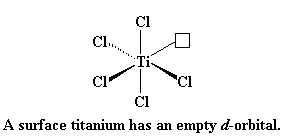
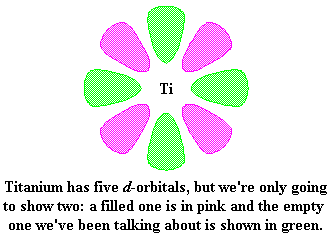
Kom ons kyk weer 'n bietjie na titaan. Die voorstelling hier onder wys titaan en twee van sy d-orbitale. Ons wys egter net twee op hierdie stadium, om dinge makliker verstaanbaar te maak.
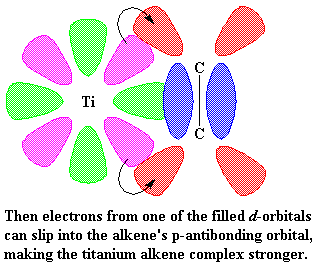
Hoe presies die kompleks wat gevorm word tussen titaan en die propileen werk, is gekompliseerd. Maar, om dinge te vereenvoudig, sal ons die sisteem net voorstel soos dit aan die begin gedoen is:
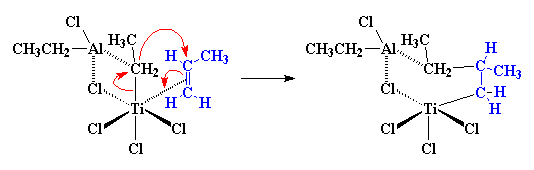
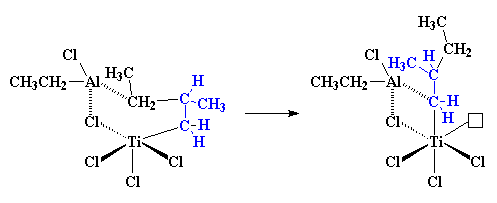
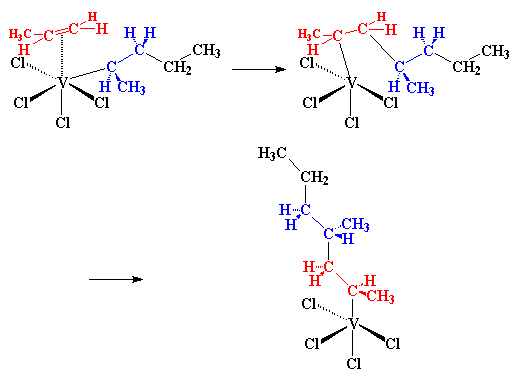
Wat volgende gebeur word as 'n migrasie geklassifiseer. Ons weet nie hoekom dit gebeur nie, dit gebeur net. Die atome herrangskik hulle self om 'n ietwat verskillende struktuur te vorm:
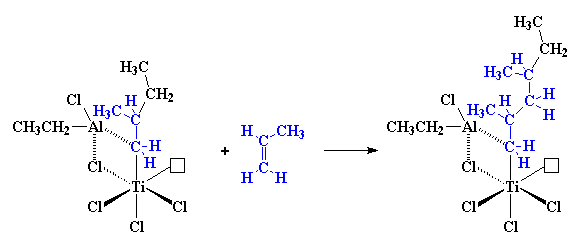
So, as nog 'n propileenmolekule nader kom, word die hele proses weer van voor af herhaal, met 'n eindresultaat wat so sal lyk:
en so sal dit voort gaan, en die polimeerketting sal groei en groei. As jy na die figuur kyk, sal jy sien dat al die metielgroepe van die groeiende polimeerketting aan dieselfde kant van die ketting is. Met hierdie meganisme verky ons dus isotaktiese polipropileen. Die inkomende propileenmolekuul kan slegs reageer as dit in die regte rigting wys (vir een of ander onverklaarbare rede), die rigting wat isotaktiese polipropileen lewer.
Kliek hier om 'n film te sien van 'n isotaktiese Ziegler-Natta polimerisasie.
Deel Twee: Sindiotaktiese Polimerisasie
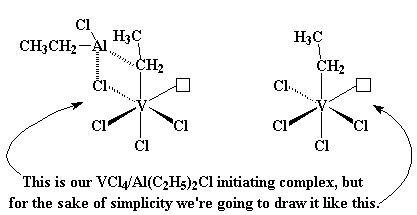
Die katalissiteem waarna ons nou gekyk het, lewer slegs isotaktiese polimere. Maar ander sisteme kan sindiotaktiese polimere lewer. Die een wat volgende ondersoek gaan word is gebasseer op vanadium, eerder as titaan. Die sisteem is
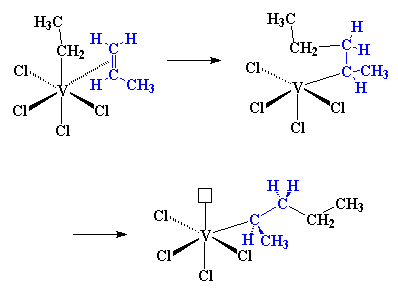
VCl4/Al(C2H5)2Cl. Dit lyk soos die figuur hier links, nie veel verskillend van die titaansisteem waarna ons nou net gekyk het nie. Maar om dinge te vereenvoudig, gaan ons gedurende hierdie bespreking slegs dit teken wat jy aan die regterkant sal sien.
Kliek hier om 'n film te sien van hoe die sindiotaktiese Ziegler-Natta polimerisasie werk.
Alkeen-metaal komplekse
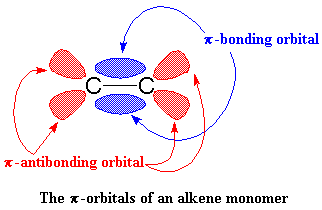
Dinge begin nou regtig interessant raak. Kom ons neem aan 'n vinielmonomeer, soos byvoorbeeld propileen. Kom ons kyk na die koolstof-koolstof dubbelbinding van die monomeer om sy kompleksering beter te verstaan. 'n Koolstof-koolstof dubbelbinding bestaan uit 'n s binding en 'n p binding. Ons gaan nou die p binding van naderby beskou.
Die Polimerisasie
Deel Een: Isotaktiese Polimerisasie
Beperkings
Ziegler-Natta polimerisasie is 'n baie goeie manier om polimere te maak van koolwaterstof monomere soos etileen en propileen. Maar dit werk nie met ander tipes monomere nie. Byvoorbeeld, ons kan nie polivinielchloried maak m.b.v. Ziegler-Natta polimerisasie nie. Wanneer die katalis en ko-katalis bymekaar kom om die inisiasiekompleks te vorm, word radikale geproduseer gedurende die tussenstappe. Hierdie radikale kan 'n vrye radikaal polimerisasie van die vinielchloried monomeer tot gevolg hê. Akrilate kan ook nie op hierdie manier gepolimeriseer word nie, aangesien Ziegler-Natta kataliste anioniese vinielpolimerisasies in sulke monomere inisiëer.
Die Pad Vorentoe
Vir 'n lang tyd was Ziegler-Natta polimerisasies die mees bruikbare en veranderlike reaksie vir die produksie van 'n polimeer met 'n spesifieke gekose taktisiteit. Maar onlangs is daar 'n nuwe tipe polimerisasie ontwikkel, wat ook metaalkomplekse as inisiëerders gebruik. Dit is die sogenaamde metalloseen katalise polimerisasie. Lees gerus meer!
 Terug na die Vlak Vier Kaart
Terug na die Vlak Vier Kaart Terug na die
Macrogalleria Indeks
Terug na die
Macrogalleria Indeks